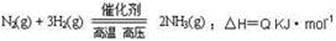题目内容
下列各表述与示意图一致的是
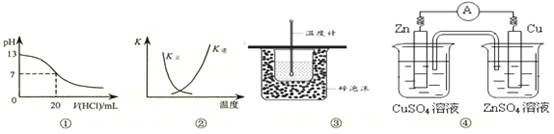

| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③装置用于测定中和热 |
| D.图④装置可以构成锌、铜、硫酸铜溶液原电池 |
B
A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、根据量热计的结构可知实验装置缺少环形玻璃搅拌棒,故C错;D、图④装置不能构成锌、铜、硫酸铜溶液原电池,应将硫酸铜和硫酸锌位置互换,D错。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 H2+I2(g)
H2+I2(g) 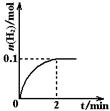
 H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。
H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)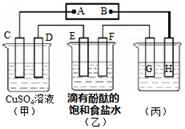
 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 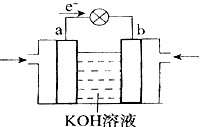
 H=-393.5kJ/mol
H=-393.5kJ/mol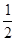 Y2(g)=WY2(g);
Y2(g)=WY2(g);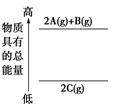
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是