题目内容
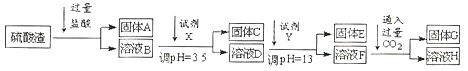
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。
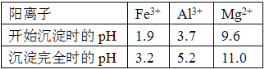
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
【答案】SiO2+2NaOH==Na2SiO3+H2O Mg(OH)2 250ml容量瓶 D AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
【解析】
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加入过量的盐酸时,二氧化硅和盐酸不反应,所以A是二氧化硅,Fe2O3、Al2O3、MgO和盐酸反应,所以溶液B的溶质为氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加入试剂X并调节溶液的pH值为3.5,结合题意溶液pH=3.5时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,固体C是氢氧化铁,向溶液D中加入试剂X并调节溶液的pH值为13,溶液成强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子结合生成氢氧化镁沉淀,所以固体E为氢氧化镁,溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入二氧化碳气体,偏铝酸钠与二氧化碳反应沉淀氢氧化铝沉淀,所以G为氢氧化铝,据此答题。
(1)由分析可知:固体A为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O。
(2)由分析可知:固体E为Mg(OH)2,故答案为:Mg(OH)2。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶和胶头滴管;故答案为:250mL容量瓶。
(4)阳离子Mg2+以氢氧化物形式沉淀所需试剂,根据题给信息和流程可知应该先用氢氧化钠溶液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-溶液;故答案为:D。
(5)F→H的反应是AlO2-与CO2反应,过量CO2反应的产物为碳酸氢盐,反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-。

 53随堂测系列答案
53随堂测系列答案