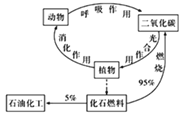
题目内容
【题目】下列叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L的NaCl溶液
B.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L
C.将w g a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
D.将1体积c1 mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1 mol/L
【答案】D
【解析】
A.将5.85 g NaCl晶体溶入100 mL水中,所得溶液的体积不是100mL;
B. 25 g无水CuSO4的物质的量大于0.1 mol,所得溶液的浓度大于0.1 mol/L;
C.蒸发饱和氯化钠溶液的过程中会析出NaCl,则稀释后氯化钠溶液的质量分数小于2a%;
D.根据稀释过程中硫酸的物质的量不变计算。
A. 5.85 gNaCl的物质的量为0.1 mol,0.1 mol氯化钠溶于100 mL水中,所得溶液的体积不是100 mL,因此得到的溶液浓度不是1 mol/L,A错误;
B. 25 g无水CuSO4的物质的量为:![]() =0.156 mol > 0.1 mol,溶液的体积是0.1 L,所以所得溶液的浓度大于1mol/L,B错误;
=0.156 mol > 0.1 mol,溶液的体积是0.1 L,所以所得溶液的浓度大于1mol/L,B错误;
C.将w g a%的饱和NaCl溶液蒸发掉![]() g水,蒸发过程中会有NaCl晶体析出,得到的仍然是该温度下的饱和溶液,所以到溶液的质量分数仍然是a%,C错误;
g水,蒸发过程中会有NaCl晶体析出,得到的仍然是该温度下的饱和溶液,所以到溶液的质量分数仍然是a%,C错误;
D.将1体积c1 molL-1的硫酸用水稀释至5体积,稀释过程中溶质的物质的量不变,则稀溶液的浓度为:![]() =0.2c1 mol/L,D正确;
=0.2c1 mol/L,D正确;
故合理选项是D。

 阅读快车系列答案
阅读快车系列答案【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。

化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。

①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。