题目内容
11.实验室模拟以天青石(主要成分为硫酸锶,含不溶性杂质)为原料制备碳酸锶的流程图如下: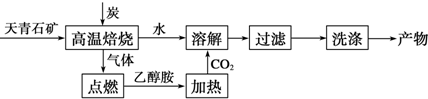
试回答下列问题:
(1)高温焙烧过程中另一产物为硫化物,且只该硫化物可溶于水.试写出该过程的化学方程式:4C+SrSO4$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(2)15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,在上述合成线路中用作气体的吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-.
(3)已知,酸性:H2S>H2CO3>HS-,则溶解过程中的离子方程式为:CO2+Sr2++2S2-+H2O═SrCO3↓+2HS-.
(4)碳酸锶的另一种制备方法是用天青石和Na2CO3溶液混合浸泡制得,反应的离子方程式为SrSO4+CO32-?srCΟ3+SO42-,已知Ksp(SrSO4)=3×10-7,Ksp(SrCO3)=1×10-10,则该反应的平衡常数等于3000.如果将Na2CO3换成(NH4)2CO3,SrCO3的产率将降低,其原因是两者浓度相等时,Na2CO3溶液中c(CO32-)大于(NH4)2CO3溶液中c(CO32-),有利于碳酸锶的形成.
分析 天青石(主要成分为硫酸锶,含不溶性杂质)与碳在高温下焙烧制得硫化锶,同时产生能点燃的气体,应为一氧化碳,硫化锶溶于水得硫化锶溶液,硫化锶溶液中通入二氧化碳,生成碳酸锶沉淀,将沉淀洗涤可得碳酸锶,
(1)根据上面的分析可知,硫酸锶与碳在高温下反应生成硫化锶和一氧化碳;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)根据强酸制弱酸的原理,酸性:H2S>H2CO3>HS-,所以在硫化钙溶液中通入二氧化碳生成碳酸锶和HS-,据此书写离子方程式;
(4)反应SrSO4+CO32-?srCΟ3+SO42-的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{4}^{2-})}$=$\frac{c(S{O}_{4}^{2-})•c(S{r}^{2+})}{c(C{O}_{4}^{2-})•c(S{r}^{2+})}$=$\frac{K{\;}_{sp}(SrS{O}_{4})}{K{\;}_{sp}(SrC{O}_{3})}$;Na2CO3换成(NH4)2CO3,则SrCO3的产率将降低,由SrSO4+CO32-?SrCO3+SO42-可知,与碳酸根离子浓度有关.
解答 解:天青石(主要成分为硫酸锶,含不溶性杂质)与碳在高温下焙烧制得硫化锶,同时产生能点燃的气体,应为一氧化碳,硫化锶溶于水得硫化锶溶液,硫化锶溶液中通入二氧化碳,生成碳酸锶沉淀,将沉淀洗涤可得碳酸锶,
(1)根据上面的分析可知,硫酸锶与碳在高温下反应生成硫化锶和一氧化碳,反应方程式为4C+SrSO4$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,
故答案为:4C+SrSO4$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
故答案为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
(3)根据强酸制弱酸的原理,酸性:H2S>H2CO3>HS-,所以在硫化钙溶液中通入二氧化碳生成碳酸锶和HS-,反应的离子方程式为CO2+Sr2++2S2-+H2O═SrCO3↓+2HS-,
故答案为:CO2+Sr2++2S2-+H2O═SrCO3↓+2HS-;
(4)反应SrSO4+CO32-?srCΟ3+SO42-的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{4}^{2-})}$=$\frac{c(S{O}_{4}^{2-})•c(S{r}^{2+})}{c(C{O}_{4}^{2-})•c(S{r}^{2+})}$=$\frac{K{\;}_{sp}(SrS{O}_{4})}{K{\;}_{sp}(SrC{O}_{3})}$=$\frac{3×1{0}^{-7}}{1×1{0}^{-10}}$=3000,Na2CO3换成(NH4)2CO3,当两者浓度相等时,Na2CO3溶液中c(CO32-)大于(NH4)2CO3溶液中c(CO32-),则由SrSO4+CO32-?SrCO3+SO42-可知,SrCO3的产率将降低,
故答案为:3000;两者浓度相等时,Na2CO3溶液中c(CO32-)大于(NH4)2CO3溶液中c(CO32-),有利于碳酸锶的形成.
点评 本题考查金属及化合物的综合应用,为高频考点,把握氧化还原反应、盐类水解、溶度积的计算等为解答的关键,侧重分析与应用、计算能力的考查,题目难度中等.

| A. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 100mL0.1mol/L Na2SO4溶液中,粒子总数是0.03NA | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
| A. | Li2SO4难溶于水 | B. | LiOH与Li2CO3受热都很难分解 | ||
| C. | LiOH易溶于水 | D. | Li与N2反应产物是Li3N2 |
| A. | 2 min内,v(H2O2)=2 mol.L-1•min-l | |
| B. | MnOp是催化剂,能加快H2 O2的分解速率 | |
| C. | 升高温度或增大H2 O2的浓度,均能加快H2O2的分解速率 | |
| D. | 若将5 mol•L-1 H2O2溶液的体积增至6 mL,则H2O2的分解速率增至原来的2倍 |
| A. | 酸A可能是CH3COOH | B. | 酸A可能是H2SO4 | ||
| C. | 碱B可能是Ba(OH)2 | D. | 碱B可能是CH3CH2OH |
| A. | 显蓝色、无现象、显黄色 | B. | 显蓝色、红色沉淀、无现象 | ||
| C. | 无现象、变黑色、显黄色 | D. | 无现象、红色沉淀、无现象 |
| A. | Cu2S只作还原剂,O2只作氧化剂 | B. | Cu2S中Cu的化合价为+2价 | ||
| C. | 每生成1molSO2,转移电子6mol | D. | 每生成2molCu,转移电子2mol |
| A. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| B. | 常温条件下c(H+)=10-12 mol•L-1的溶液:K+、SO42-、Cl-、Br- | |
| C. | 酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |