题目内容
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:___________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
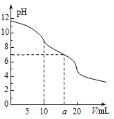
操作时,不同pH环境中粒子种类如下图所示:
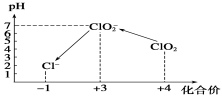
请回答:
①操作Ⅰ中反应的离子方程式是______________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是____________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
【答案】(1)氧化;(2)K2SO4
(3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
①2ClO2+2I-===2ClO2-+I2;②蓝色消失,且半分钟内不变色
③ClO2-+4I-+4H+===Cl-+2I2+2H2O;④0.675
【解析】
试题分析:(1)在这个过程中,Fe2+、Mn2+的化合价升高,则ClO2的化合价降低,为氧化剂,具有氧化性,故答案为:氧化性;
(2)质量守恒可得:2KClO3+SO2=2ClO2+K2SO4,故答案为:K2SO4;
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290 kJ,热化学方程式为2Cl2(g) + 2H2O(g) + C(s)═4HCl(g) + CO2(g)△H = -290 kJmol-1,故答案为:2Cl2(g) + 2H2O(g) + C(s)═4HCl(g) + CO2(g)△H = -290 kJmol-1;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2 + 2I- = 2ClO2- + I2,故答案为:2ClO2 + 2I- = 2ClO2- + I2;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O;
④S2O32- ~ I- ~ ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mgmol-1=0.675mg,由于水样为 1L,所以 ClO2 的浓度为![]() =0.675 mgL-1,故答案为:0.675。
=0.675 mgL-1,故答案为:0.675。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。