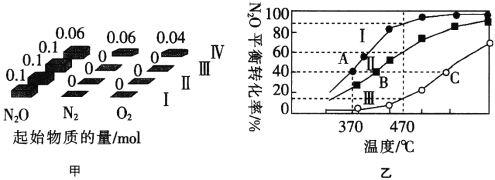
题目内容
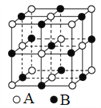
【题目】A、B、C三种短周期元素,它们在周期表中的位置如图:
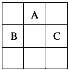
A原子核内质子数和中子数相等;B、C两元素原子核外电子数之和是A原子质量数的2倍。则:
(1)元素名称为A________、B________、C________。
(2)B和C最高价氧化物对应的水化物的化学式是________、________。
【答案】氧 磷 氯 H3PO4 HClO4
【解析】
A、B、C三种短周期元素,A原子核内质子数和中子数相等,B、C两元素原子核外电子数之和是A原子质量数的2倍,根据三者的位置关系,设A的核内质子数为x,核内质子数也为x,则2(x+x)=(x+7)+(x+9),解得x=8,因此A、B、C分别为O、P、Cl元素,据此分析解答。
(1)根据上述分析,A、B、C分别为O、P、Cl元素,名称分别为氧、磷、氯,故答案为:氧;磷;氯;
(2)B和C最高价氧化物对应的水化物分别为磷酸和高氯酸,化学式分别为H3PO4、HClO4,故答案为:H3PO4;HClO4。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式______________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)