题目内容
亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是而机合成中的重要试剂。某同学用下图装置,由NO与干燥纯净的Cl2反应制备NOCl。
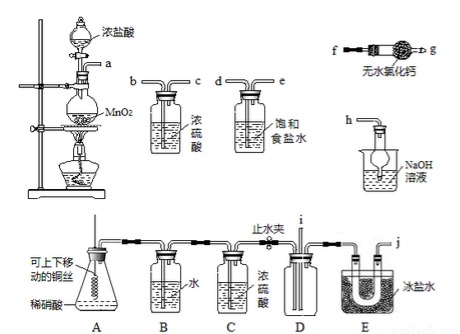
己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃
②2NO+Cl2= 2NOC1 2NO2 + Cl2=2NO2C1
2NO2 + Cl2=2NO2C1
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为_______________;装置A中设计了可上下移动的铜丝,其优点是_____________________。
(2)上图中实验装置的连接顺序为:a→__________________。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______________;
装置中充满氯气后,下—步是制取NO,具体操作是_______________;
E中冰盐水的温度可低至-22℃,其作用是_______________。
(4)该同学的实验设计可能的不足之处是__________________(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是_________(用化学方程式表示)。
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)  2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0〜t1min,v(NH3)=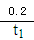 mol·L-1·min-1
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g)  2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g)  N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________

