题目内容
同周期的X、Y、Z三元素, 其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 则下列判断正确的是( )
| A.原子半径 X>Y>Z |
| B.非金属性 X>Y>Z |
| C.阴离子的还原性按X、Y、Z的顺序由强到弱 |
| D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
B
同周期自左向右原子半径逐渐减小,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,相应氢化物的稳定性逐渐增强。由于最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 所以非金属性是X>Y>Z ,选项B正确,AD不正确。非金属性越强,相应阴离子的还原性越弱,D不正确,答案选B。

练习册系列答案
相关题目
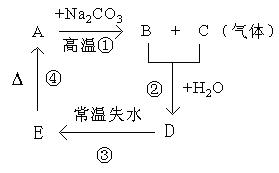
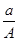 (A-N+m)mol
(A-N+m)mol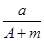 (A-N)mol
(A-N)mol