题目内容
11.60mL 0.5mol•L-1 NaOH溶液和40mL 0.4mol•L-1的H2SO4混合后,溶液的pH约为( )| A. | 0.5 | B. | 1.7 | C. | 2 | D. | 13.2 |
分析 40mL 0.4mol•L-1的H2SO4溶液n(H+)=0.04L×0.4mol/L×2=0.032mol,60mL 0.5mol•L-1 NaOH 溶液中n(OH-)=0.06L×0.5mol/L=0.03mol,酸过量,反应后溶液呈酸性,关键pH=-lgc(H+)计算混合液的pH.
解答 解:40mL 0.4mol•L-1的H2SO4溶液n(H+)=0.04L×0.4mol/L×2=0.032mol,60mL 0.5mol•L-1 NaOH 溶液中n(OH-)=0.06L×0.5mol/L=0.03mol,酸过量,
反应后溶液的体积为60mL+40mL=100mL=0.1L,
则反应后c(+)=$\frac{0.032mol-0.03mol}{0.1L}$=0.02mol•L-1,
混合液中的pH=-lgc(H+)=-lg0.02=2-lg2=1.7,
故选B.
点评 本题考查溶液pH的计算,题目难度中等,答题时注意根据酸碱溶液的浓度、体积判断过量问题,注意熟练掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
1.将下列物质按酸、碱、盐、氧化物分类排列,正确的是( )
| A. | 硫酸,纯碱,硫酸铜,氧气 | B. | 硫酸,烧碱,硝酸钡,干冰 | ||
| C. | 碳酸,乙醇,醋酸钠,水 | D. | 磷酸,熟石灰,氢氧化钾,氧化钠 |
2.下列有机物的结构简式书写正确的是( )
| A. | 3-甲基丁醛 (CH3)2CHCH2COH | B. | TNT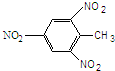 | ||
| C. | 硬脂酸甘油酯 | D. | 乙酸甲酯 CH3OOCCH3 |
19.甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的两根石墨棒C1、C2插入乙,把分别与直流电源正、负极相连的石墨棒C3、铁片插入丙.则下列叙述正确的是( )
| A. | 甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | |
| B. | C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | |
| C. | C1和C3放出的气体相同,铜片和铁片放出的气体也相同 | |
| D. | 甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
6.在某溶液中酚酞呈粉红色.下列离子在该溶液中不能大量存在的是( )
| A. | K+ | B. | Na+ | C. | Ba2+ | D. | Cu2+ |
16.下列对阿司匹林的描述错误的是( )
| A. | 化学名为乙酰水杨酸 | B. | 是一种难溶于水的白色晶体 | ||
| C. | 长期大量服用会出现不良反应 | D. | 是一种重要的抗生素即消炎药 |
3.常温下,将0.1mol•L-1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是( )
| A. | CH3COOH的电离平衡常数增大为原来的10倍 | |
| B. | CH3COO-与CH3COOH的浓度之比增大为原来的10倍 | |
| C. | CH3COOH与CH3COO-的浓度之和减小为原来的$\frac{1}{10}$ | |
| D. | CH3COO-与H+的浓度之积减小为原来的$\frac{1}{10}$ |
20.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4 g金属镁所含电子数目为0.2 NA | |
| B. | 标准状况下22.4L CH4所含原子数目为NA | |
| C. | 17 g NH3 所含质子数目为10 NA | |
| D. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
1.下列离子方程式书写正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 铁溶于过量稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 醋酸溶液与NaHCO3溶液反应:H++HCO3-═CO2↑+H2O |