题目内容
短周期元素X.Y.Z.W及生活中常见金属K,已知X原子的L层比Y原子的L层少3个电子,Y原子的最外层电子数跟X原子的核电荷数相等.Z元素的原子序数等于该元素原子的最外层电子数,K的高价氯化物形成的盐溶液,常用于印刷电路板电路的“刻蚀”.
试回答下列问题:(1)X是 ,Y是 .(填元素符号)
(2)Z分别与X.Y形成的化合物A.B均可用如图的装置制取和收集,则:
①制取纯净的气体A时分液漏斗中加入 ,制取和收集干燥的气体A时仪器接口顺序为 .
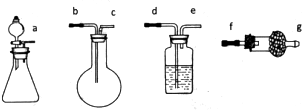
②A与B反应生成物C,通过加热C能否得到纯净得A .(填“能”或“不能”)
③该装置是否能制取Y的单质 (填“能”或“不能”),若能,则反应得离子方程式(若不能则此空不填) .
(3)W的单质可分别在X、Y的单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A,W的名称 .
(4)K在周期表中的位置为 ,现由含lmolHNO3溶质的稀硝酸与一定量的K恰好完全反应,稀硝酸的还原产物只有NO,则生成标准状况下NO的体积为 升.
试回答下列问题:(1)X是
(2)Z分别与X.Y形成的化合物A.B均可用如图的装置制取和收集,则:
①制取纯净的气体A时分液漏斗中加入

②A与B反应生成物C,通过加热C能否得到纯净得A
③该装置是否能制取Y的单质
(3)W的单质可分别在X、Y的单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A,W的名称
(4)K在周期表中的位置为
分析:短周期元素X、Y、Z、W及生活中常见金属K,已知X原子的L层比Y原子的L层少3个电子,Y原子的最外层电子数跟X原子的核电荷数相等,则X处于第二周期,Y处于第三周期,故X原子L层电子数为5,X为N元素;Y原子最外层电子数为7,为Cl元素;Z元素的原子序数等于该元素原子的最外层电子数,则Z为H元素;K的高价氯化物形成的盐溶液,常用于印刷电路板电路的“刻蚀”,则K为Fe,
(2)氢元素分别与N、Cl形成的化合物A、B,A为NH3,B为HCl,
①浓氨水与氧化钙等制备氨气,通过呈碱石灰的干燥管后,再用向上排空气法收集;
②A与B反应生成物C为NH4Cl,加热H4Cl分解生成NH3、HCl;
③用浓盐酸与高锰酸钾等反应制备氯气,反应不需要加热;
(3)W的单质可分别在氮气、氯气单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A(NH3),则W为Mg,C为Mg3N2、D为MgCl2,白色沉淀为氢氧化镁;
(4)Fe处于第四周期Ⅷ族,由方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,NO的物质的量为硝酸的
,据此计算.
(2)氢元素分别与N、Cl形成的化合物A、B,A为NH3,B为HCl,
①浓氨水与氧化钙等制备氨气,通过呈碱石灰的干燥管后,再用向上排空气法收集;
②A与B反应生成物C为NH4Cl,加热H4Cl分解生成NH3、HCl;
③用浓盐酸与高锰酸钾等反应制备氯气,反应不需要加热;
(3)W的单质可分别在氮气、氯气单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A(NH3),则W为Mg,C为Mg3N2、D为MgCl2,白色沉淀为氢氧化镁;
(4)Fe处于第四周期Ⅷ族,由方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,NO的物质的量为硝酸的
| 1 |
| 4 |
解答:解:短周期元素X、Y、Z、W及生活中常见金属K,已知X原子的L层比Y原子的L层少3个电子,Y原子的最外层电子数跟X原子的核电荷数相等,则X处于第二周期,Y处于第三周期,故X原子L层电子数为5,X为N元素;Y原子最外层电子数为7,为Cl元素;Z元素的原子序数等于该元素原子的最外层电子数,则Z为H元素;K的高价氯化物形成的盐溶液,常用于印刷电路板电路的“刻蚀”,则K为Fe,
(1)由上述分析可知,X为N,Y为Cl,故答案为:N;Cl;
(2)氢元素分别与N、Cl形成的化合物A、B,A为NH3,B为HCl,
①浓氨水与氧化钙等制备氨气,通过呈碱石灰的干燥管后,再用向上排空气法收集,故分液漏斗中加入浓氨水,制取和收集干燥的气体A时仪器接口顺序为:a→f→g→c→b,
故答案为:浓氨水;a→f→g→c→b;
②A与B反应生成物C为NH4Cl,加热H4Cl分解生成NH3、HCl,冷却后又得到NH4Cl,不能得到NH3,
故答案为:不能;
③用浓盐酸与高锰酸钾等反应制备氯气,反应不需要加热,用向上排空气法收集,可以准备氯气,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)W的单质可分别在氮气、氯气单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A(NH3),则W为Mg,C为Mg3N2、D为MgCl2,
故答案为:镁;
(4)Fe处于第四周期Ⅷ族,由方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,NO的物质的量为硝酸的
,故NO物质的量=1mol×
=0.25mol,NO的体积为0.25mol×22.4L/mol=5.6L,
故答案为:第四周期Ⅷ族;5.6.
(1)由上述分析可知,X为N,Y为Cl,故答案为:N;Cl;
(2)氢元素分别与N、Cl形成的化合物A、B,A为NH3,B为HCl,
①浓氨水与氧化钙等制备氨气,通过呈碱石灰的干燥管后,再用向上排空气法收集,故分液漏斗中加入浓氨水,制取和收集干燥的气体A时仪器接口顺序为:a→f→g→c→b,
故答案为:浓氨水;a→f→g→c→b;
②A与B反应生成物C为NH4Cl,加热H4Cl分解生成NH3、HCl,冷却后又得到NH4Cl,不能得到NH3,
故答案为:不能;
③用浓盐酸与高锰酸钾等反应制备氯气,反应不需要加热,用向上排空气法收集,可以准备氯气,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)W的单质可分别在氮气、氯气单质中燃烧,生成化合物C和D,C与水反应生成白色沉淀和化合物A(NH3),则W为Mg,C为Mg3N2、D为MgCl2,
故答案为:镁;
(4)Fe处于第四周期Ⅷ族,由方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,NO的物质的量为硝酸的
| 1 |
| 4 |
| 1 |
| 4 |
故答案为:第四周期Ⅷ族;5.6.
点评:本题考查结构性质位置关系、化学实验、无机物推断、化学计算等,题目综合性较大,推断元素是解题关键,(4)中由于Fe的量一定,不能确定硝酸盐,注意利用方程式进行计算,难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )