题目内容
现代社会中铜在不同领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
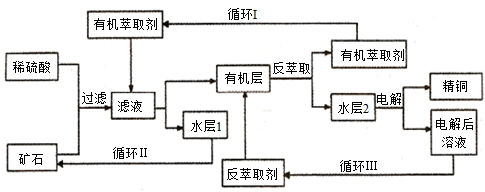
已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为____________________________________________。
(2)检验滤液中是否含有Fe3+的方法是____________________________________________________。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式________ _____________。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 __________________。
(5)“循环Ⅲ”中反萃取剂的主要成分的化学式是________________。
(6) 黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O=6Cu+SO2↑。该反应中,_______ (填化学式)作还原剂,每生成1mol Cu,反应中转移电子的物质的量为____________。

已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为____________________________________________。
(2)检验滤液中是否含有Fe3+的方法是____________________________________________________。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式________ _____________。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 __________________。
(5)“循环Ⅲ”中反萃取剂的主要成分的化学式是________________。
(6) 黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O=6Cu+SO2↑。该反应中,_______ (填化学式)作还原剂,每生成1mol Cu,反应中转移电子的物质的量为____________。
(1)CuO+2H+=Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+(每个方程2分)
(2)取少量滤液于试管中(1分),向其中加入少量KSCN溶液,若溶液变红,说明含有Fe3+,如果不变红,说明不含有Fe3+(1分)。
(3) 4Fe2++O2+4H+=4Fe3++2H2O (4) 4OH--2e-=2 H2O+ O2↑
(5)H2SO4(1分,写名称不得分) (6)Cu2S(1分);1mol(缺少单位扣1分)
(2)取少量滤液于试管中(1分),向其中加入少量KSCN溶液,若溶液变红,说明含有Fe3+,如果不变红,说明不含有Fe3+(1分)。
(3) 4Fe2++O2+4H+=4Fe3++2H2O (4) 4OH--2e-=2 H2O+ O2↑
(5)H2SO4(1分,写名称不得分) (6)Cu2S(1分);1mol(缺少单位扣1分)
试题分析:(1)氧化亚铜、氧化铜、三氧化二铁均可以和强酸发生反应生成盐和水,Cu2O+2H+=Cu2++Cu+H2O、CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。铁离子具有氧化性,能氧化金属铜,则金属铜和三价铁之间发生氧化还原反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+。
(2)铁离子能和KSCN溶液反应使溶液显红色,据此可以检验铁离子,即取少量滤液于试管中,向其中加入少量KSCN溶液,若溶液变红,说明含有Fe3+,如果不变红,说明不含有Fe3+。
(3)根据流程图可知,滤液中含有亚铁离子,因此“循环Ⅰ”经多次循环后的水层1不能继续循环使用,可分离出一种重要的晶体FeSO4?7H2O。由于亚铁离子具有还原性极易被氧化生成铁离子,所以暴露在空气中一段时间后,可被氧气氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O。
(4)电解池中阳极失去电子,发生氧化反应。所以电解硫酸铜时,阳极上是氢氧根离子发生失电子的氧化反应,电极反应式为4OH--4e-=O2↑+2H2O。
(5)电极硫酸铜后有硫酸生成,因此“循环Ⅲ”中反萃取剂的主要成分是硫酸,化学式为H2SO4。
(6)根据反应可知Cu2S+2Cu2O=6Cu+SO2↑,Cu2S中S元素化合价从-2价升高到+4价,被氧化,Cu2S是还原剂。根据方程式可知,铜元素的化合价从+1价降低到0价,得到1个电子,所以每生成1mol Cu,反应中转移电子的物质的量为1mol。

练习册系列答案
相关题目

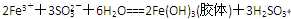 ……
…… 水解能力较
水解能力较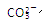 小外,还有___________________________________。
小外,还有___________________________________。