题目内容
【题目】某学习小组利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去。)
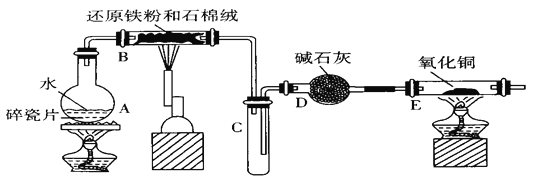
(1)装置B中发生反应的化学方程式是_____________________________________。
(2)装置E中的现象是_____________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤,简述检验滤液中Fe3+的操作方法:_____________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
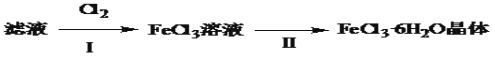
①步骤Ⅰ中通入Cl2发生反应的离子方程式______________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_________________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 黑色固体变红,右端管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否出现血红色 Cl2+2Fe2+==2Cl-+2Fe3+ 加热浓缩,冷却结晶,过滤
Fe3O4+4H2 黑色固体变红,右端管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否出现血红色 Cl2+2Fe2+==2Cl-+2Fe3+ 加热浓缩,冷却结晶,过滤
【解析】
根据物质性质书写化学方程式;根据实验原理及装置分析实验现象;根据铁离子的检验原理分析解答;根据溶液中溶质的性质分析物质分离提纯的操作方法。
(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)用KSCN溶液检验滤液中Fe3+,观察溶液是否出现血红色,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否出现血红色;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,故答案为:Cl2+2Fe2+==2Cl-+2Fe3+
②由FeCl3稀溶液中得到FeCl36H2O晶体需加热浓缩、冷却结晶、过滤,故答案为:加热浓缩、冷却结晶、过滤。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
