题目内容
下列表达式书写正确的是
| A.CaCO3的电离方程式:CaCO3=Ca2++CO32- |
B.HCO3-的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| D.CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO32-(aq) |
AB
解析试题分析:A、碳酸钙难溶于水,但属于强电解质,因此CaCO3的电离方程式CaCO3=Ca2++CO32-,A正确;B、HCO3-是弱酸的酸式根,其电离方程式为HCO3-+H2O H3O++CO32-,B正确;C、CO32-是弱酸的酸根,因此CO32-的水解方程式为CO32-+H2O
H3O++CO32-,B正确;C、CO32-是弱酸的酸根,因此CO32-的水解方程式为CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O OH-+H2CO3,C不正确;D、溶解平衡是动态平衡,因此CaCO3的沉淀溶解平衡表达式为CaCO3(s)
OH-+H2CO3,C不正确;D、溶解平衡是动态平衡,因此CaCO3的沉淀溶解平衡表达式为CaCO3(s) Ca2+(aq)+CO32-(aq),D不正确,答案选AB。
Ca2+(aq)+CO32-(aq),D不正确,答案选AB。
考点:考查电离方程式、水解方程式、溶解平衡表达式的正误判断

练习册系列答案
相关题目
下列有关碳酸钠或碳酸氢钠能发生水解的观点正确的是
A.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-,通入CO2,平衡朝正反应方向移动 HCO3-+OH-,通入CO2,平衡朝正反应方向移动 |
| B.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡 |
| C.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低 |
| D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
某温度时,AgCl(s)  Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是
| A.加入AgNO3,可以使溶液由c点变到d点 |
| B.加入少量水,平衡右移,Cl-浓度减小 |
| C.d点没有AgCl沉淀生成 |
| D.c点对应的Ksp等于a点对应的Ksp |
下列说法正确的是( )
| A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成 |
| C.25℃时,AgCl水溶液中,c(Ag+)和c(Cl-)的乘积是一个常数 |
| D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
下列事实可证明一水合氨是弱电解质的是
| A.0.1mol/L的氨水可使酚酞试液变红 |
| B.0.1mol/L的氯化铵溶液的pH约为5 |
| C.在相同条件下,氨水溶液的导电性比强碱溶液弱 |
| D.铵盐受热易分解 |
已知Ksp(AgCl)=1.8×10—10mol2?L—2,Ksp(AgI)=1.0×10—16mo2?L—2。下列说法错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI |
| C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol?L—1 ×10—11mol?L—1 |
下列说法正确的是
| A.直接加热蒸干FeCl3溶液,可得FeCl3固体 |
| B.加入催化剂可加快反应速率,并提高反应物的转化率 |
| C.pH值相同的CH3COOH溶液和NH4Cl溶液中,水的电离程度相同 |
| D.可用Na2CO3溶液处理水垢中的CaSO4,转化为易于除去的CaCO3 |
常温下,向20.00mL 0.1000 mol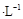 (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol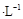 NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
