题目内容
【题目】甲醇(CH3OH)是一种新型清洁能源。回答问题:
(1)101KPa、25℃时,燃烧32g液态甲醇生成液态水和二氧化碳放热726.5kJ,则甲醇燃烧的热化学方程式为_____________
已知:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-24.5kJ·mol-1
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1
CH3OH(g) △H=akJ·mol-1
则2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) △H=__________
(2)工业上可用CO和H2制取甲醇,其热化学反应方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1,CO在不同温度下的平衡转化率与压强的关系如下图所示
CH3OH(g) △H=akJ·mol-1,CO在不同温度下的平衡转化率与压强的关系如下图所示
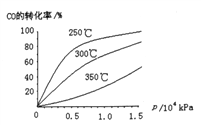
①△H______0(填“﹥”或“<”).判断依据是___________________
②为提高CO转化率,可采取的措施是_____________________________(至少答出两条)
③实际生产中,反应的条件控制在250℃,1.3×104kPa左右,选择此压强的理由是______________________。
【答案】 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=-1453 kJmol-1 (2a-24.5)kJmol-1 < 由图像可知,升高温度,CO的转化率降低,平衡逆向移动,逆反应为吸热反应,故△H<0 增大压强,增大H2浓度,降低温度 在250℃、此压强下,转化率比较高,再增加压强转化率增加不大,但对设备的要求会更高,生产投资更高。
【解析】试题分析:本题考查热化学方程式的书写,盖斯定律的应用,化学平衡图像的分析,外界条件对化学平衡的影响。
(1)n(CH3OH)=32g![]() 32g/mol=1mol,则甲醇燃烧的热化学方程式为:CH3OH(l)+
32g/mol=1mol,则甲醇燃烧的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol(或2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=-1453 kJmol-1)。
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol(或2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=-1453 kJmol-1)。
将反应编号:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-24.5kJ·mol-1(①式)
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1(②式)
CH3OH(g) △H=akJ·mol-1(②式)
应用盖斯定律,将①式+②式![]() 2,得2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g)ΔH=(-24.5kJ/mol)+akJ/mol
2,得2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g)ΔH=(-24.5kJ/mol)+akJ/mol![]() 2=(2a-24.5)kJ/mol。
2=(2a-24.5)kJ/mol。
(2)①在横坐标上任取一点作横坐标的垂直线与曲线相交,由图像可知,升高温度,CO的转化率降低,平衡向逆反应方向移动,逆反应为吸热反应,故△H<0。
②该反应的正反应为气体分子数减小的放热反应,提高CO的转化率可采取的措施有:增大压强、降低温度、增大H2的浓度。
③实际生产中,反应的条件控制在250℃,1.3×104kPa左右,选择此压强的理由是:在250℃、此压强下,转化率比较高,再增加压强转化率增加不大,但对设备的要求会更高,生产投资更高。

【题目】下图是牙膏中某些主要成分检验流程图,请回答以下问题:
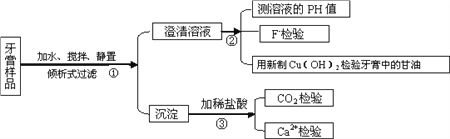
(1)牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏的摩擦作用和去污效果,不同种类的牙膏含有的摩擦剂有所不同,在上述流程图的第③步加入盐酸后会产生不同现象,请你填空:
摩擦剂 | 实验中出现的现象 | 解 释 |
SiO2 | ________________ | _____________ |
CaCO3 | ________________ | ______________ |
Ca3(PO4)2 | 溶解无气体,加NaOH至过量后又产生沉淀 | ______________ |
Al(OH)3 | 溶解无气体,加NaOH至过量先产生沉淀后溶解 | _______________ |
(2)日常生活中使用的牙膏里面都含有一定量的摩擦剂,试回答下列相关问题:
A.根据你的推测,摩擦剂应具备下列性质中的哪几条?________________
①易溶于水 ②难溶于水 ③坚硬 ④柔软 ⑤颗粒较大 ⑥颗粒较小
B.据调查,两面针儿童牙膏、珍珠王防臭牙膏和中华透明牙膏中所使用的摩擦剂依次是氢氧化铝、碳酸钙和二氧化硅,它们所属的物质类别依次是________________、____________、___________。
C.作牙膏摩擦剂的粉末状碳酸钙可以用石灰石来制备。以下是一种制备碳酸钙的生产方案,其流程图为,请你写出上述方案中有关反应的化学方程式:
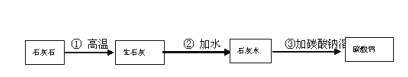
①_______________ ②________________ ③___________________
(3)新制Cu(OH)2的配制方法是__________________________。
牙膏中含有一定量的甘油,其主要功能是作保湿剂,在流程图的第②步得到的澄清溶液中加入新制Cu(OH)2,产生的现象是_____,化学方程式为_________
(4)实验测定澄清溶液的pH>7,可能原因是___________。
(5)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(固) ![]() 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:_____________,根据以上原理,请你提出一种其它促进矿化的方法_________________________
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。