题目内容
【题目】电化学原理在工业生产、生活中有重要的作用
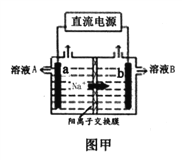
(1)图甲是工业上用惰性电极电解饱和食盐水的原理示意图,a电极为_______极,电极反应式为________,溶液B为_______溶液,电解总反应的离子方程式为_____________.标况下生成33.6Cl2,通过离子交换膜的Na+物质的量为__________.
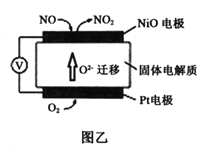
(2)通过NO传感器可检测NO的质量,其工作原理示意图如图乙。Pt电极上发生的是_________反应(填“氧化”或“还原”);写出NiO电极的电极反应式是______________。
【答案】 阳极 2Cl- -2e- = Cl2↑ NaOH 2Cl-+2H2O ![]() H2↑+Cl2↑+2OH- 3mol 还原 NO-2e-+ O2- =NO2
H2↑+Cl2↑+2OH- 3mol 还原 NO-2e-+ O2- =NO2
【解析】试题分析:本题考查氯碱工业的原理和计算,原电池原理的应用。
(1)电解池中,阳离子向阴极移动,图甲中Na+从左向右移动,则a电极为阳极,b电极为阴极。a电极上的电极反应式为:2Cl--2e-=Cl2↑。b电极上的电极反应式为2H++2e-=H2↑,阴极附近水的电离平衡被破坏,水的电离向电离方向移动,H+继续放电,b极附近c(OH-)![]() c(H+),溶液B为NaOH溶液。电解总反应的化学方程式为:2NaCl+2H2O
c(H+),溶液B为NaOH溶液。电解总反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,离子方程式为:2Cl-+2H2O
2NaOH+H2↑+Cl2↑,离子方程式为:2Cl-+2H2O ![]() H2↑+Cl2↑+2OH-。n(Cl2)=33.6L
H2↑+Cl2↑+2OH-。n(Cl2)=33.6L![]() 22.4L/mol=1.5mol,则通过离子交换膜的Na+的物质的量为3mol。
22.4L/mol=1.5mol,则通过离子交换膜的Na+的物质的量为3mol。
(2)原电池中阴离子向负极移动,根据图乙中O2-的迁移方向判断,Pt电极为正极,NiO电极为负极。由于Pt电极为正极,Pt电极上发生得电子的还原反应,电极反应式为:O2+4e-=2O2-。NiO电极上NO失电子被氧化成NO2,电极反应式为:NO-2e-+O2-=NO2。

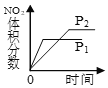
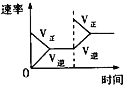
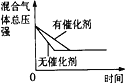
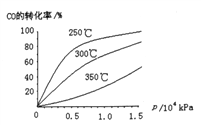
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A | B | C | D | |
目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. A B. B C. C D. D