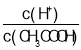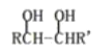题目内容
【题目】(1)在密闭容器中进行下列反应:M(g) + N(g)![]() R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
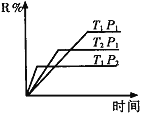
①T1______T2 ,正反应的△H______0。(填“>”、“<”或“=”,下同)。
②P1________P2, L为_______。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)![]() H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
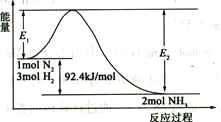
①在反应体系中加入催化剂,反应速率增大,E2的变化是_______(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量____92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是_________(填字母)。
A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为_____________mol、_____________。
【答案】< < < 气态 减小 < AD 4 60%
【解析】
(1)①根据图像可知,当压强均为P1时,温度为T2的曲线首先达到平衡状态,这说明温度是T2>T1。但温度高,R的含量低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
②根据图像可知,当温度均为T1时,压强为P2的曲线首先达到平衡状态,这说明P2>P1。但压强高,R的含量低,这说明增大越强平衡向逆反应方向移动,因此正方应是体积增大的可逆反应,即L一定是气态。
(2)①催化剂能降低反应的活化能,但不能改变反应热,所以在反应体系中加入催化剂,反应速率增大。由于E1减小,反应热不变,所以E2的变化一定是减小。
②由于该反应是可逆反应,因此若在一密闭容器中加入1molN2和3molH2,不可能生成2mol氨气,因此在一定条件下充分反应,放出的热量<92.4kJ。
③A、向容器中按原比例再充入原料气,相当于增大压强,平衡向正反应方向移动,氢气的转化率增大,A正确;B、向容器中再充入一定量H2,平衡向正反应方向,但氢气转化率降低,B不正确;C、改变反应的催化剂,反应速率变化,平衡状态不变,则氢气的转化率不变,C不正确;D、液化生成物分离出氨,降低生成物浓度,平衡向正反应方向移动,氢气的转化率增大,D正确,答案选AD。
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,这说明平衡应该是等效的。由于温度和容器容积不变,则氨气的物质的量完全转化为氮气和氢气应该是2mol和6mol,所以需要氨气的物质的量是4mol;平衡时生成氨气的物质的量是2mol×40%×2=1.6mol,因此如果从4mol氨气开始建立平衡状态,则氨气的转化率是=![]() ×100%=60%。
×100%=60%。

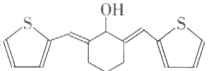
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取9.0g A,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:_____。 |
(2)将此9.0g A在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______。 |
(3)另取9.0g A,跟足量的碳酸氢钠粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
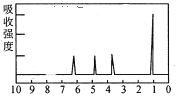
(4)A的核磁共振氢谱如图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式__________。 | |
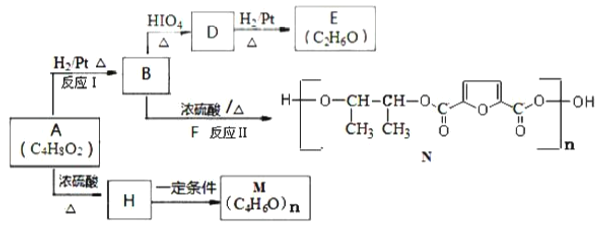
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ