题目内容
13.F是新型降压药替米沙坦的中间体,可由下列路线合成:
(1)A→B的反应类型是氧化反应,D→E的反应类型是还原反应;
(2)C中含有的官能团名称是硝基、羧基,已知固体C在加热条件下可溶于甲醇,
下列C→D的有关说法正确的是acd;
a.使用过量的甲醇,是为了提高D的产率 b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇既是反应物,又是溶剂 d.D的化学式为C9H9NO4
(3)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是
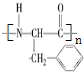 (写结构简式);
(写结构简式);(4)由B转化为C的化学方程式是
 ;
;(5)F在一定条件下水解的有机产物的种类最多为3种.
分析 C与甲醇反应生成D,由D的结构可知C为 ,B与浓硝酸发生取代反生成C,则B为
,B与浓硝酸发生取代反生成C,则B为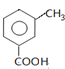 ,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,苯丙氨酸中分子之间羧基和氨基脱水形成肽键,聚合成高分子,据此写高聚物的结构简式,以此解答.
,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,苯丙氨酸中分子之间羧基和氨基脱水形成肽键,聚合成高分子,据此写高聚物的结构简式,以此解答.
解答 解:C与甲醇反应生成D,由D的结构可知C为 ,B与浓硝酸发生取代反生成C,则B为
,B与浓硝酸发生取代反生成C,则B为 ,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,
,A发生氧化反应生成B,D中硝基被还原为氨基生成E,E与CH3CH2CH2COCl发生取代反应生成F,
(1)B为 ,A发生氧化反应生成B,D中硝基被还原为氨基生成E,故答案为:氧化反应;还原反应;
,A发生氧化反应生成B,D中硝基被还原为氨基生成E,故答案为:氧化反应;还原反应;
(2)C为 ,含有硝基、羧基官能团,C在加热条件下与甲醇发生酯化反应,酯化反应为可逆反应,使用过量的甲醇,是为了提高C的转化率,a项正确,导致溶液变黑为浓硫酸的脱水性,b项错误,在该反应中甲醇既是反应物,又是溶剂,c项正确,d项正确,故答案为:硝基、羧基;a、c、d;
,含有硝基、羧基官能团,C在加热条件下与甲醇发生酯化反应,酯化反应为可逆反应,使用过量的甲醇,是为了提高C的转化率,a项正确,导致溶液变黑为浓硫酸的脱水性,b项错误,在该反应中甲醇既是反应物,又是溶剂,c项正确,d项正确,故答案为:硝基、羧基;a、c、d;
(3)苯丙氨酸中分子之间羧基和氨基脱水形成肽键,聚合成高分子,此高聚物的结构简式为 ,故答案为:
,故答案为: ;
;
(4)C为 ,B制备C的反应为硝化反应,反应的方程式为
,B制备C的反应为硝化反应,反应的方程式为 ,
,
故答案为: ;
;
(5)F中含有酯基和肽键,在一定条件下水解能够生成3种产物,故答案为:3.
点评 本题考查有机物的推断与合成、官能团的结构与性质、同分异构体书写等,题目难度中等,要充分利用有机物的结构进行分析解答.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 二氧化硫体现还原性,做还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
4.反应X(g)+Y(s)?2Z(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率和平衡都没有影响的是( )
| A. | 升高温度 | B. | 增加Y的用量 | C. | 减小压强 | D. | 使用催化剂 |
1.下列仪器不能加热的是( )
| A. | 燃烧匙、蒸发皿 | B. | 圆底烧瓶、坩埚 | C. | 量筒、容量瓶 | D. | 试管、锥形瓶 |
8.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)?2Z(g)△H=-Q kJ•mol-1]:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol X、3mol Y | 2mol Z | 4mol Z |
| Z的浓度 (mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=Q | C. | 2p2<p3 | D. | α1+α3>1 |
5.铁酸钠是水处理过程中使用的一种新型净水剂.铁酸钠之所以能净水,是因为该 物质既能消毒杀菌、其反应后的产物又能吸附杂质.制取铁酸钠(M)的化学方程式为:2FeNO3+16NaOH+3CI2═2M+6NaNO3+6NaCI+8H2O.则M的化学式是( )
| A. | NaFeO4 | B. | Na2FeO4 | C. | NaFe2O4 | D. | Na2Fe3O8 |
2.“关注民生”和“科学发展”是“十七大”报告的主题之一,下列有关叙述符合科学规律的是( )
| A. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 | |
| B. | 白色污染与塑料垃圾有关 | |
| C. | 臭氧空洞的形成与化石燃料大量使用有关 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |

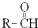 +
+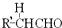 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ (-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A:
(-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A: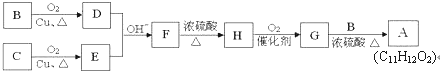
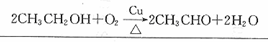
 .
.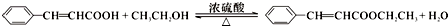
 .
.