题目内容
16.将0.1mol某液态烃X完全燃烧,将产物通过足量的浓硫酸,浓硫酸增重5.4g,然后将剩余气体通入足量的澄清石灰水中,得到60g沉淀.X不能使酸性KMnO4溶液褪色,也不能与溴的四氯化碳溶液反应而使其褪色.在催化剂存在时,7.8gX能与amolH2发生加成反应生成相应的饱和烃Y.请回答下列问题:(1)a=0.3.
(2)X能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2 +H2O,该反应属于取代反应,有机产物的名称是硝基苯.
(3)写出Y在空气中完全燃烧的化学方程式:
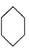 +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.
分析 浓硫酸增重的5.4g为水的质量,则水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,则X分子中含有H原子数为:$\frac{0.3mol×2}{0.1mol}$=6,
将剩余气体通入足量的澄清石灰水中得到的60g沉淀为碳酸钙,根据C原子守恒可知0.1molX中含有C的物质的量为:$\frac{60g}{100g/mol}$=0.6mol,则X分子中含有C原子数为:$\frac{0.6mol}{0.1mol}$=6,所以X的分子式为:C6H6,X不能使酸性KMnO4溶液褪色,也不能与溴的四氯化碳溶液反应而使其褪色,则X分子中不存在碳碳双键,故X为苯;苯与氢气反应的方程式为: ,则Y为环己烷,据此进行解答.
,则Y为环己烷,据此进行解答.
解答 解:浓硫酸增重的5.4g为水的质量,则水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,则X分子中含有H原子数为:$\frac{0.3mol×2}{0.1mol}$=6;得到的60g沉淀为碳酸钙,根据C原子守恒可知0.1molX中含有C的物质的量为:$\frac{60g}{100g/mol}$=0.6mol,则X分子中含有C原子数为:$\frac{0.6mol}{0.1mol}$=6,所以X的分子式为:C6H6,X不能使酸性KMnO4溶液褪色,也不能与溴的四氯化碳溶液反应而使其褪色,则X分子中不存在碳碳双键,故X为苯,
(1)7.8g苯的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,根据反应 可知,0.1mol苯完全反应消耗0.3mol氢气,则a=0.3,
可知,0.1mol苯完全反应消耗0.3mol氢气,则a=0.3,
故答案为:0.3;
(2)苯与浓硝酸在浓硫酸作用下发生取代反应生成硝基苯和水,反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2 +H2O,有机产物的名称为硝基苯,
故答案为:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2 +H2O;取代;硝基苯;
(3)苯与氢气发生加成反应生成环己烷,则Y为环己烷,环己烷燃烧的化学方程式为: +9O2$\stackrel{点燃}{→}$6CO2+6H2O,
+9O2$\stackrel{点燃}{→}$6CO2+6H2O,
故答案为: +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.

| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 含不同碳原子数的烷烃一定互为同系物 | |
| C. | 结构对称的烷烃,其一氯取代产物必定只有一种 | |
| D. | 分子通式相同且组成上相差一个或几个CH2原子团的物质互为同系物 |
| A. | 聚丙烯的结构简式: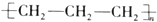 | B. | 四氯化碳分子的电子式: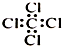 | ||
| C. | 2-乙基-1,3-丁二烯分子的键线式: | D. | 丙烷分子的比例模型: |
| A. | pH=4的醋酸中:c(H+)=4.0molL-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1 | |
| D. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |
| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
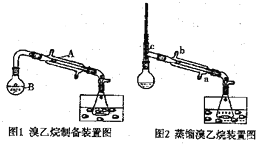
(1)①仪器A的名称是:直形冷凝管;
②容器B的容积是:c,
a.150mLb.200mLc.250mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取)bd,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的c(从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若实验中使用的无水乙醇的体积是46mL,蒸馏后得到的纯溴乙烷的体积是50rnL,则溴乙烷的产率为80.275%.
 ,H2O2
,H2O2 Na2O2
Na2O2 ,NH4+
,NH4+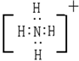
 CaF2
CaF2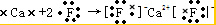 .
.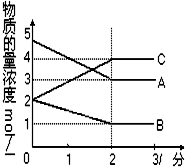 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.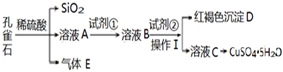 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图: