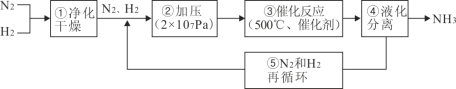
题目内容
【题目】乙醇在一定条件下可以被氧气氧化为乙醛,下面是一位同学对这个反应的实验设计。请你解答其中的问题。实验装置如图:
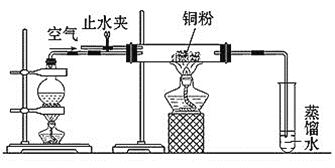
操作步骤:
①加热铜粉末,同时鼓入空气。
②加热烧瓶。
③停止加热烧瓶,然后再鼓入空气。
④再加热烧瓶。
⑤停止加热,取下试管,验证产物。
(1)该实验装置在实验前需要检验装置气密性,请你叙述检验方法:________。
(2)烧瓶中盛装的液体是____,为了防止反应的____,在烧瓶中需要事先放置几片碎瓷片。
(3)操作步骤②时,玻璃管中粉末的颜色由___色变为___色,发生该反应的化学方程式是________。
(4)操作⑤中,在试管中的溶液中滴入____,加热后试管内出现红色沉淀,实验中提供了酒精灯、火柴、胶头滴管等,为完成该实验,还需要一种非玻璃仪器。该仪器的名称是___。
(5)当该同学把这个实验设计呈交老师时,老师以该实验方法存在安全隐患而否定了他的实验方法。请你评价该实验可能存在的危险是___________
【答案】关闭止水夹,点燃玻璃管下的酒精灯,微热玻璃管,如果试管中的细玻璃管中有气泡冒出,停止微热后,细玻璃管中有水柱上升,且短时间内不回落,则表明装置气密性良好 无水乙醇 暴沸 黑 亮红 CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 新制Cu(OH)2悬浊液 试管夹 热的乙醇气体是可燃性气体,在加热的体系中同时通入可燃性气体与空气是危险的,很容易发生爆炸
CH3CHO+Cu+H2O 新制Cu(OH)2悬浊液 试管夹 热的乙醇气体是可燃性气体,在加热的体系中同时通入可燃性气体与空气是危险的,很容易发生爆炸
【解析】
(1)设法使装置内外形成气压差是气密性检查的常用手段,据此分析结合装置解答;
(2)乙醇沸点低,在该反应中,为了防止暴沸而加入少量碎瓷片;
(3)玻璃管中粉末为铜,铜受热与氧气反应变成黑色的氧化铜,氧化铜和乙醇发生氧化反应变成红色的铜,乙醇被催化氧化成乙醛;
(4)检验乙醛需检验醛基,可用新制的氢氧化铜悬浊液;夹持试管需试管夹;
(5)在加热的体系中同时通入可燃性气体与空气易发生爆炸。
(1)检验气体制备装置气密性的原理就是将装置的一端导管口插入水中,再对气体发生装置微热,看导管中是否有气泡,若产生气泡,证明气密性良好,或停止加热,看导管中是否有回流的水柱,若产生回流的水柱,且不回落,就证明装置气密性良好。
(2)在烧瓶中加热液体物质是乙醇,且需要液体加热至沸腾的实验,为防止产生暴沸现象,都需要添加沸石(碎瓷片),以防止突然发生的沸腾而导致的爆炸。
(3)步骤①Cu粉与O2反应产生CuO,加热烧瓶,发生反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O,所以看到的现象是固体粉末由黑色变为亮红色。
CH3CHO+Cu+H2O,所以看到的现象是固体粉末由黑色变为亮红色。
(4)乙醇被催化氧化产生乙醛,新制Cu(OH)2悬浊液可以用来检验含有醛基的物质,所以操作⑤中,在试管中的溶液中滴入新制Cu(OH)2悬浊液,若加热后试管内出现红色沉淀,证明产生了乙醛。为完成该实验,除了需要使用酒精灯、火柴、胶头滴管等外,夹持试管需要试管夹,所以还需要的一种非玻璃仪器就是夹持试管的试管夹。
(5)老师认为该实验方法存在安全隐患而否定了他的实验方法。该实验可能存在的危险是可燃性气体与氧化剂混合,在温度高的时候可能会导致爆炸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
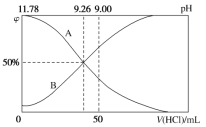
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。