题目内容
【题目】Ⅰ.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等)。
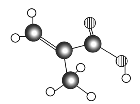
(1)该物质的结构简式为___________________________。
(2)该物质中所含官能团的名称为________________。
(3)下列物质中,与该物质互为同分异构体的是________(填序号,下同),与该物质互为同系物的是________。
①CH3CH![]() CHCOOH ②CH2
CHCOOH ②CH2![]() CHCOOCH3
CHCOOCH3
③CH3CH2CH![]() CHCOOH ④CH3CH(CH3)COOH
CHCOOH ④CH3CH(CH3)COOH
Ⅱ.某化合物的分子式为C5H12O,经分析数据知,分子中有两个—CH3,两个—CH2—、一个![]() 和一个—OH。则:
和一个—OH。则:
(1)它的可能结构有________种。
(2)请写出一种它可能的结构简式:__________________。
【答案】![]() 碳碳双键和羧基 ①② ③ 4 CH3CH2CHOHCH2CH3
碳碳双键和羧基 ①② ③ 4 CH3CH2CHOHCH2CH3
【解析】
Ⅰ.(1)根据图示的该有机物的分子模型判断结构简式;
(2)根据所含有的官能团命名;
(3)同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;具有相同分子式而结构不同的化合物互为同分异构体;
Ⅱ.分子式为C5H12O的饱和一元醇,书写烷烃的一元代物的异构体可以按照以下步骤来做:
①先确定烷烃的碳链异构,即烷烃的同分异构体;②找出等效的氢原子;③根据先中心后两边的原则,将羟基逐一去代替氢原子,据此判断符合条件的同分异构体数目。
Ⅰ.(1)由分子模型可知该有机物的结构简式为![]() ;
;
(2)该物质中所含官能团的名称为碳碳双键和羧基;
(3)该有机物的结构简式为![]() ,与之互为同分异构的有①CH3CH═CHCOOH,②CH2═CHCOOCH3;与之互为同系物的有③CH3CH2CH═CHCOOH;
,与之互为同分异构的有①CH3CH═CHCOOH,②CH2═CHCOOCH3;与之互为同系物的有③CH3CH2CH═CHCOOH;
Ⅱ.戊烷的同分异构体有CH3-CH2-CH2-CH2-CH3、![]() 、
、 ;若为CH3-CH2-CH2-CH2-CH3,饱和一元醇有:CH3CH2CH2CH2CH2OH;CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3;其中CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3符合条件;若为
;若为CH3-CH2-CH2-CH2-CH3,饱和一元醇有:CH3CH2CH2CH2CH2OH;CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3;其中CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3符合条件;若为![]() ,饱和一元醇有:CH3CH(CH3)CH2CH2OH;CH3CH(CH3)CHOHCH3;CH3COH(CH3)CH2CH3;CH2OHCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2OH;CH2OHCH(CH3)CH2CH3符合条件;若为
,饱和一元醇有:CH3CH(CH3)CH2CH2OH;CH3CH(CH3)CHOHCH3;CH3COH(CH3)CH2CH3;CH2OHCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2OH;CH2OHCH(CH3)CH2CH3符合条件;若为 ,饱和一元醇有:CH3C(CH3)2CH2OH,不符合条件;
,饱和一元醇有:CH3C(CH3)2CH2OH,不符合条件;
(1)它的可能结构有4种;
(2)满足条件的结构简式如CH3CH2CHOHCH2CH3。