题目内容
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
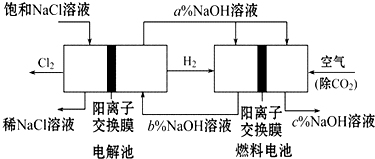
回答下列有关问题:
(1)通入空气的电极为 (写电极名称).燃料电池中阳离子的移动方向 (“从左向右”或“从右向左”).
(2)电解池中产生20mol Cl2,理论上燃料电池中消耗 mol O2.
(3)a、b、c的大小关系为: .
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池放电时正极反应式是 .

回答下列有关问题:
(1)通入空气的电极为
(2)电解池中产生20mol Cl2,理论上燃料电池中消耗
(3)a、b、c的大小关系为:
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池放电时正极反应式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)燃料电池中,通入空气的一极为正极,正极发生氧化反应,原电池工作时,阳离子向正极移动,阴离子向负极移动;
(2)依据电解池和原电池中电子守恒计算得到;
(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;
(4)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应.
(2)依据电解池和原电池中电子守恒计算得到;
(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;
(4)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应.
解答:
解:(1)燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,即H2-2e-+2OH-=2H2O,正极是氧气发生得电子得还原反应,即O2+4e-+2H2O=4OH-,通空气的电极为正极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,即阳离子从左向右移动,
故答案为:正极;从左向右;
(2)电解池中产生20mol Cl2,依据电子守恒,O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,得到2Cl2~O2,计算得到生成氧气10mol,
故答案为:10;
(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b,
故答案为:c>a>b;
(4)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-.
故答案为:正极;从左向右;
(2)电解池中产生20mol Cl2,依据电子守恒,O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,得到2Cl2~O2,计算得到生成氧气10mol,
故答案为:10;
(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b,
故答案为:c>a>b;
(4)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-.
点评:本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注意利用电子守恒进行计算,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
某同学将一小块金属钠投入到硫酸铜溶液中,通过此实验不能证明下列性质中的( )
| A、钠比水轻但比煤油重 |
| B、钠的熔点较低 |
| C、钠与水反应时要放出热量 |
| D、钠与水反应后溶液呈碱性 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、7.8g Na2O2所含的阴离子数目为2NA |
| B、在熔融状态下,lmol KHSO4完全电离出的阳离子数目为2NA |
| C、14g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |
泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应ICN→I+CN,发现该变化可在200飞秒内完成.已知(CN)2和卤素的性质相似.以下有关ICN的叙述中正确的是( )
| A、ICN不能和NaOH溶液反应 |
| B、ICN是一种共价化合物 |
| C、将ICN加入到氯水中可生成I2 |
| D、ICN的晶体是离子晶体 |
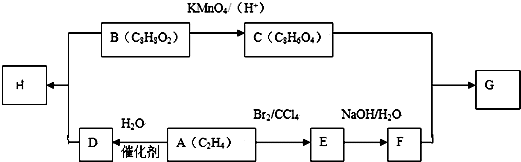
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)