题目内容
一密闭容器中充入1 mol N2和3 mol H2,在一定条件下反应。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
D
解析试题分析:A、氮气与氢气合成氨气的反应是可逆反应,N2不可能完全转化为NH3,错误;B、达到化学平衡时,N2、H2和NH3的物质的量浓度不一定相等,错误;C、达到化学平衡时,正反应和逆反应的速率都不为零,但相等,错误;D、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化,符合化学平衡的特征,正确,答案选D。
考点:考查化学平衡的判断

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
已知在t3时刻改变曲线b某一实验条件,下列判断正确的是
| A.曲线a是500℃时的图像 |
B.从0到t1时刻,反应物X(g)的 |
C.t2时刻生成物Z的量 |
| D.t3时刻改变的条件可能是降温 |
在一定条件下,CO(g)和H2(g)发生反应:CO(g) + 2H2(g)  CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表: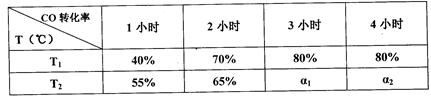
下列说法中正确的是
| A.热化学方程式中a>0 |
| B.T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L.h) |
| C.T1℃下,该反应的化学平衡常数为25 |
| D.T2℃下,ɑ1=ɑ2﹥80% |
为了探究外界条件对反应aX(g)+bY(g)  cZ(g)的影响,以X和Y物质的量之比为a∶
cZ(g)的影响,以X和Y物质的量之比为a∶
b开始反应,通过实验得到不同条件下达到平衡时Z的体积分数,实验结果如下图所示。以下判断正确的是( )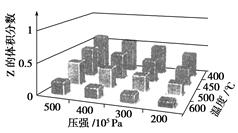
| A.ΔH>0,a+b>c | B.ΔH>0,a+b<c |
| C.ΔH<0,a+b>c | D.ΔH<0,a+b<c |
纳米是长度单位,1纳米等于1×10-9 m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快 |
| B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快 |
| C.常温下“纳米铜”的还原性大于铜片的还原性 |
| D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )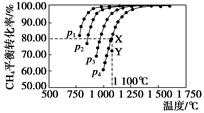
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2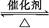 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为2X+3Y
 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡向正反应方向移动
在2NO2(红棕色) N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
| A.N2O4和NO2的分子数比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.平衡体系的颜色不再改变 |
| D.单位时间内有1 mol N2O4变为NO2的同时,有1 mol NO2变为N2O4 |