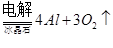题目内容
【化学—选修2:化学与技术】(15分)
 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
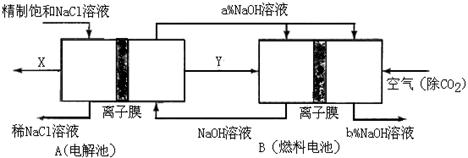
 ①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题: (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果); (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号) (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。 
 ①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________; ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____; ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。(15分)(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2分)
(2)③①②(2分) (3)①Cl2(1分) a%小于b% (2分)
②O2+4e-+2H2O=4OH- (2分) H2-2e-+2OH-=2H2O (2分)
③燃料电池可以补充电解池消耗的电能(2分));提高产出碱液的浓度(2分;降低能耗(其他合理答案也给分)
(2)③①②(2分) (3)①Cl2(1分) a%小于b% (2分)
②O2+4e-+2H2O=4OH- (2分) H2-2e-+2OH-=2H2O (2分)
③燃料电池可以补充电解池消耗的电能(2分));提高产出碱液的浓度(2分;降低能耗(其他合理答案也给分)
(1)惰性电极电解饱和食盐水的方程式为2NaCl+2H2O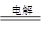 2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
(2)由于除去SO42-时要加入过量的氯化钡溶液,而过量的氯化钡需要碳酸钠除去,所以正确的操作顺序是③①②。
(3)①由于在燃料电池中失去电子的是氢气,所以Y是氢气,则X就是氯气。由于燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%。
②负极是氢气失去电子,正极氧气得到电子,所以电极反应式分别为H2-2e-+2OH-=2H2O 、O2+4e-+2H2O=4OH- 。
③根据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等。
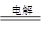 2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。(2)由于除去SO42-时要加入过量的氯化钡溶液,而过量的氯化钡需要碳酸钠除去,所以正确的操作顺序是③①②。
(3)①由于在燃料电池中失去电子的是氢气,所以Y是氢气,则X就是氯气。由于燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%。
②负极是氢气失去电子,正极氧气得到电子,所以电极反应式分别为H2-2e-+2OH-=2H2O 、O2+4e-+2H2O=4OH- 。
③根据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

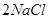 (熔融)
(熔融)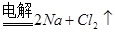

 (熔融)
(熔融)