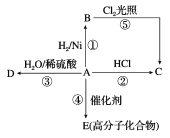
题目内容
【题目】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
【答案】D
【解析】A、a点NaOH与HA物质的量相等,则二者恰好完全反应,生成NaA,反应后溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,则c(Na+)>c(A-)>c(HA)>c(H+),A错误;B、a点NaA发生水解反应,促进了水的电离,所以a点水的电离程度大于b点,B错误;C、根据电荷守恒,c(H+)+c(Na+)=c(OH)+c(A-),则pH=7时,c(H+)=c(OH),带入电荷守恒表达式可得:
c(Na+)= c(A-),C错误;D、根据图像可知b点HA过量,因为b点溶液pH=4.7,则溶液呈酸性,故HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)![]() CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)![]() CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)的ΔH= ;
CH3OCH3(g) + CO2(g)的ΔH= ;