题目内容
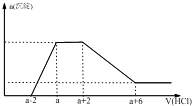 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )| A、不含SO42- | B、含有的阴离子一定是OH-、AlO2-、SiO32- | C、含有的阴离子一定是OH-、CO32-、AlO2-、SiO32- | D、含有AlO2-与SiO32-的物质的量之比为3:1 |
分析:依据图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的OH-反应,则与氢氧根离子反应的离子不能共存:Mg2+、Al3+;然后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,但根据溶液的电中性可知,溶液中一定存在Na+离子,据此进行解答.
解答:解:由图象可知,开始加入HCl时无沉淀生成,说明加入的HCl与溶液中OH-的反应,则溶液中一定不会存在与氢氧根离子发生反应的离子:Mg2+、Al3+;之后开始生成沉淀且反应生成沉淀逐渐增大,说明溶液中存在AlO2-、SiO32-,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,碳酸根离子反应完后继续加入盐酸,沉淀逐渐减小,直至沉淀的物质的量不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定存在Na+离子,
A.根据分析可知,无法判断溶液中是否存在硫酸根离子,故A错误;
B.依据推断可知原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,故B错误;
C.根据以上分析可知,元溶液中一定存在的阴离子是:OH-、SiO32-、AlO2-、CO32-,故C正确;
D.设盐酸的浓度为c,氢氧化铝溶解消耗的盐酸体积为4体积,氯化氢的物质的量为4c,根据反应Al(OH)3+3H+=Al3++3H2O可知,铝离子的物质的量为
×4c;AlO2-、SiO32-生成氢氧化铝、硅酸沉淀,总共消耗了2体积的盐酸,其中偏铝酸根离子生成氢氧化铝沉淀消耗的盐酸的体积为:
=
体积,则硅酸消耗的盐酸的体积为:2-
=
体积,根据反应关系式SiO32-~2HCl,硅酸根离子的物质的量为:
×
c=
c,所以原溶液中含有AlO2-与SiO32-的物质的量之比为:
c:
c=4:1,故D错误;
故选C.
A.根据分析可知,无法判断溶液中是否存在硫酸根离子,故A错误;
B.依据推断可知原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,故B错误;
C.根据以上分析可知,元溶液中一定存在的阴离子是:OH-、SiO32-、AlO2-、CO32-,故C正确;
D.设盐酸的浓度为c,氢氧化铝溶解消耗的盐酸体积为4体积,氯化氢的物质的量为4c,根据反应Al(OH)3+3H+=Al3++3H2O可知,铝离子的物质的量为
| 1 |
| 3 |
| ||
| c |
| 4 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 1 |
| 3 |
| 4 |
| 3 |
| 1 |
| 3 |
故选C.
点评:本题考查了离子检验的方法应用,图象分析判断是解题关键,硅酸根离子、偏铝酸根离子和酸反应生成沉淀,氢氧化铝是两性氢氧化物溶于强酸是解题关键,选项D为难点和易错点,注意掌握求算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )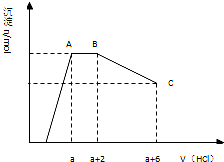 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示: