题目内容
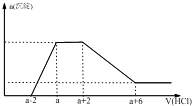
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化的如下图所示,下列说法正确的是( )

A、原溶液一定含有Na2SO4
B、反应最后形成的溶液中的溶质为NaCl
C、原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32-
D、原溶液中含有CO32- 与AlO2-的物质的量之比为1:1
【答案】
C
【解析】根据图像可知,最初没有沉淀生成,这说明溶液中一定含有OH-,则溶液中就一定没有Fe3+、Mg2+、Al3+等离子,因此根据溶液的电中性可知,一定含有钠离子。根据图像可知,当沉淀不再发生变化时,继续加入盐酸,盐酸仍然被消耗,所以一定含有CO32-。如果继续再加入盐酸,沉淀开始减少,但不完全消失,这说明沉淀一定是氢氧化铝和硅酸沉淀,所以溶液中一定含有AlO2-、SiO32-。和碳酸钠反应的盐酸是2体积,而与氢氧化铝反应的盐酸是4体积,所以原溶液中含有CO32- 与AlO2-的物质的量之比为1:4。由于不能确定是否含有SO42-,所以选项A是和B是不正确的,因此正确的答案选C。

练习册系列答案
相关题目
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )| A、不含SO42- | B、含有的阴离子一定是OH-、AlO2-、SiO32- | C、含有的阴离子一定是OH-、CO32-、AlO2-、SiO32- | D、含有AlO2-与SiO32-的物质的量之比为3:1 |
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )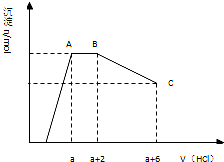 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示: