题目内容
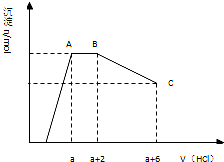 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:回答下列问题:(已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)
(1)原混合溶液中一定含有的离子是:
(2)AB段反应的离子方程式是:
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:
分析:依据图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的OH-反应,能够氢氧根离子反应的离子不能共存:Fe3+、Mg2+、Al3+;然后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,与盐酸反应的离子为CO32-,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种,
(1)根据以上分析判断出溶液中一定存在的离子;
(2)AB段为碳酸根离子与盐酸中的氢离子发生反应,反应分步进行,先生成碳酸氢根离子,然后碳酸氢根离子与氢离子反应生成二氧化碳和水,据此写出反应的离子方程式;
(3)AB段反应的离子为碳酸根离子、BC段为氢氧化铝溶解,根据AB段、BC段消耗盐酸的体积及发生的反应方程式计算出碳酸根离子与氢氧化铝的物质的量之比.
(1)根据以上分析判断出溶液中一定存在的离子;
(2)AB段为碳酸根离子与盐酸中的氢离子发生反应,反应分步进行,先生成碳酸氢根离子,然后碳酸氢根离子与氢离子反应生成二氧化碳和水,据此写出反应的离子方程式;
(3)AB段反应的离子为碳酸根离子、BC段为氢氧化铝溶解,根据AB段、BC段消耗盐酸的体积及发生的反应方程式计算出碳酸根离子与氢氧化铝的物质的量之比.
解答:解:由图象可知,开始加入HCl时无沉淀生成,说明加入的HCl与溶液中OH-的反应,则溶液中一定不会存在与氢氧根离子发生反应的离子:Fe3+、Mg2+、Al3+;之后开始生成沉淀且反应生成沉淀逐渐增大,说明溶液中存在AlO2-、SiO32-,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,碳酸根离子反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种离子,
(1)根据以上分析可知,原溶液中一定含有的离子是:OH-、SiO32-、AlO2-、CO32-,
故答案为:OH-、SiO32-、AlO2-、CO32-,;
(2)AB段碳酸根离子与盐酸发生反应,反应分步进行,反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,
故答案为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;
(3)依据图象可知和碳酸根离子反应的盐酸为2体积,反应总方程式为:CO32-+2H+=CO2↑+H2O;氢氧化铝溶解消耗的盐酸体积为4体积,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;所以原溶液中含有CO32-与Al(OH)3的物质的量之比为n(CO32-):n(Al(OH)3)=2×
:4×
=3:4,
故答案为:3:4.
(1)根据以上分析可知,原溶液中一定含有的离子是:OH-、SiO32-、AlO2-、CO32-,
故答案为:OH-、SiO32-、AlO2-、CO32-,;
(2)AB段碳酸根离子与盐酸发生反应,反应分步进行,反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,
故答案为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;
(3)依据图象可知和碳酸根离子反应的盐酸为2体积,反应总方程式为:CO32-+2H+=CO2↑+H2O;氢氧化铝溶解消耗的盐酸体积为4体积,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;所以原溶液中含有CO32-与Al(OH)3的物质的量之比为n(CO32-):n(Al(OH)3)=2×
| 1 |
| 2 |
| 1 |
| 3 |
故答案为:3:4.
点评:本题考查了离子检验的方法应用,题目难度中等,明确偏铝酸根离子先与酸反应生成沉淀后沉淀又溶解是解题关键,注意掌握常见离子的检验方法及某些离子具有的特征反应.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示.由此可知原溶液中( )| A、不含SO42- | B、含有的阴离子一定是OH-、AlO2-、SiO32- | C、含有的阴离子一定是OH-、CO32-、AlO2-、SiO32- | D、含有AlO2-与SiO32-的物质的量之比为3:1 |
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )