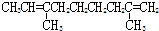题目内容
14.写出下列物质的电离方程式:BaCl2=BaCl2=Ba2++2Cl-
Na2SO4=Na2SO4=2Na++SO42-
Fe(OH)3Fe(OH)3
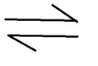 Fe3++3OH-.
Fe3++3OH-.
分析 氯化钡为强电解质,完全电离生成钡离子与氯离子;
硫酸钠为强电解质,完全电离生成钠离子与硫酸根离子;
氢氧化铁为弱电解质,部分电离生成三价铁离子与氢氧根离子.
解答 解:氯化钡为强电解质,完全电离生成钡离子与氯离子,电离方程式:BaCl2=Ba2++2Cl-;
故答案为:BaCl2=Ba2++2Cl-;
硫酸钠为强电解质,完全电离生成钠离子与硫酸根离子,电离方程式:Na2SO4=2Na++SO42-;
故答案为:Na2SO4=2Na++SO42-;
氢氧化铁为弱电解质,部分电离生成三价铁离子与氢氧根离子,离子方程式:Fe(OH)3  Fe3++3OH-;
Fe3++3OH-;
故答案为:Fe(OH)3  Fe3++3OH-.
Fe3++3OH-.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意多元弱碱分步电离,但是书写时一步写到位,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子4 mol | |
| C. | O2一定是氧化产物 | |
| D. | Na2O2不可能发生还原反应 |
5.下列有关化学反应速率的说法中,正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
2.下列有关叙述错误的是( )
| A. | 化学反应均伴随着能量的变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 物质的化学能可以在一定条件下转化为热能、电能为人类利用 | |
| D. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
6.下列反应中生成物总能量高于反应物总能量的是( )
| A. | NH4Cl晶体受热分解 | B. | 木炭燃烧 | ||
| C. | 钠与水反应 | D. | 酸碱中和反应 |
4.目前科学家提出了一种最经济最理想的获得氢能源的循环体系(如图).下列说法错误的是( )
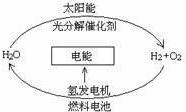

| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |