题目内容
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为10.47%,乙中c电极质量增加.回答问题: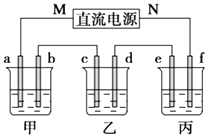
(1)电源的N端为极;
(2)电极b上发生的电极反应式为;
(3)丙装置损失的质量为(该处保留两位有效数字);电极b上生成的气体在标准状况下的体积为;
(4)电极c的质量变化是g;
(5)①若该直流电源为甲烷燃料电池,电解质溶液为KOH溶液.通入甲烷的铂电极上发生的电极反应式为 .
②已知上述燃料电池中,每转移1mol电子,就有 112KJ的化学能转化为电能.写出常温下甲烷燃烧的热化学方程式 .
【答案】
(1)正
(2)4OH﹣﹣4e﹣=2H2O+O2↑
(3)4.49g;2.8L
(4)16g
(5)CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣896kJ/mol
【解析】解:(1)该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明c电极是电解池阴极,则d电极是阳极,连接电解池阳极的N端电极是正极,所以答案是:正;(2)电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;(3)l00g 10.00%的K2SO4溶液电解一段时间后K2SO4浓度变为 ![]() ,电解硫酸钾溶液实际上是电解的水,所以电解水的质量为100﹣
,电解硫酸钾溶液实际上是电解的水,所以电解水的质量为100﹣ ![]() =4.49g,减少4.49g水即为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则电极b上生成的气体在标准状况下的体积为
=4.49g,减少4.49g水即为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则电极b上生成的气体在标准状况下的体积为 ![]() ×22.4L/mol=2.8L;所以答案是:4.49g;2.8L;(4)因为连接电解池阳极的N端电极是正极,则M为负极,所以c电极为析出铜,由(3)得整个反应中转化0.5mol电子,则电极c增加的质量=
×22.4L/mol=2.8L;所以答案是:4.49g;2.8L;(4)因为连接电解池阳极的N端电极是正极,则M为负极,所以c电极为析出铜,由(3)得整个反应中转化0.5mol电子,则电极c增加的质量= ![]() ×64g/mol=16g.所以答案是:16g;(5)①甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,
×64g/mol=16g.所以答案是:16g;(5)①甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,
所以答案是:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;
②每转移1mol电子,就有112KJ的化学能转化为电能,所以1mol甲烷燃烧生成二氧化碳和液态水放热112kJ×8=896kJ,
甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣896kJ/mol;
所以答案是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣896kJ/mol.

 阅读快车系列答案
阅读快车系列答案