题目内容
【题目】按如图所示装置进行实验,并回答下列问题: 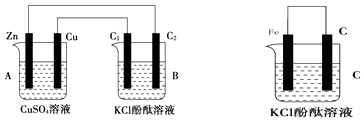
(1)判断装置的名称:A池为 , B池为 .
(2)锌极为极,电极反应式为;石墨棒C1为极,电极反应式为;石墨棒C2附近发生的实验现象为 .
(3)写出C 装置中溶液颜色变红的电极反应式: .
(4)当C2极析出224mL气体(标准状况下)时,CuSO4溶液的质量变化了g.
【答案】
(1)原电池;电解池
(2)负;Zn﹣2e﹣═Zn2+;阳;2Cl﹣﹣2e﹣=Cl2↑;有无色气泡产生附近溶液变红色
(3)O2+2H2O+4e﹣=4OH﹣
(4)0.01
【解析】解:(1)A装置能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B装置有外接电源,属于电解池,所以答案是:原电池;电解池;(2)锌为负极,电极反应式Zn﹣2e﹣═Zn2+ , 铜为正极,铜极上的电极反应式为Cu2++2 e﹣=Cu,石墨棒C1为阳极,电极反应式为2Cl﹣﹣2e﹣=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e﹣=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,所以答案是:负;Zn﹣2e﹣═Zn2+;阳;2Cl﹣﹣2e﹣=Cl2↑;有无色气泡产生附近溶液变红色(3)C 装置为铁的吸氧腐蚀装置,则碳电极为氧气得电子发生还原反应生成氢氧根离子,遇酚酞变红,则电极反应式为:O2+2H2O+4e﹣=4OH﹣ , 所以答案是:O2+2H2O+4e﹣=4OH﹣;(4)C2极析出的气体是氢气,氢气的物质的量= ![]() =0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量=
=0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量= ![]() ×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,正极电极反应式为Cu2++2e﹣=Cu,转移0.02mol电子,析出0.64gCu,所以溶液质量增加0.01g,
×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,正极电极反应式为Cu2++2e﹣=Cu,转移0.02mol电子,析出0.64gCu,所以溶液质量增加0.01g,
所以答案是:0.01.