题目内容
下列说法错误的是( )
分析:A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高;
B、根据周期表的结构分析;
C、根据离子化合物的概念分析;
D、全部由非金属组成的化合物可能是离子化合物如铵盐.
B、根据周期表的结构分析;
C、根据离子化合物的概念分析;
D、全部由非金属组成的化合物可能是离子化合物如铵盐.
解答:解:A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高,所以在多电子的原子里,能量高的电子通常在离核远的区域内活动,故A错误;
B、元素周期表中,在金属与非金属的分界线附近的元素既有金属的性质有非金属的性质,能作半导体材料,故B正确;
C、由离子化合物的概念可知,含有离子键的化合物是离子化合物,故C正确;
D、含有离子键的化合物是离子化合物,全部由非金属组成的化合物如果含有离子键就是离子化合物,如氯化铵全部由非金属组成,是离子化合物,故D正确;
故选:A.
B、元素周期表中,在金属与非金属的分界线附近的元素既有金属的性质有非金属的性质,能作半导体材料,故B正确;
C、由离子化合物的概念可知,含有离子键的化合物是离子化合物,故C正确;
D、含有离子键的化合物是离子化合物,全部由非金属组成的化合物如果含有离子键就是离子化合物,如氯化铵全部由非金属组成,是离子化合物,故D正确;
故选:A.
点评:本题考查了核外电子的能量分布,元素周期表的结构,离子化合物的概念,题目较简单,根据有关概念分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法错误的是( )
| A、C2H4和C4H8一定都能使溴水退色 | B、C2H6和C4H10一定是同系物 | C、C3H6不只表示一种物质 | D、烯烃中各同系物中碳的质量分数相同 |
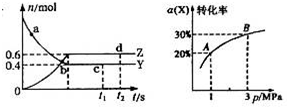 (2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )
(2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )