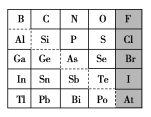
题目内容
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
【答案】(1)Na(2分) Cl (2分) (2)PH3(2分)
(3)NH4Cl(2分) 离子键和共价键(2分)
(4)H3PO4(2分) (5)2P+5Cl2![]() 2PCl5(2分) PCl3(2分)
2PCl5(2分) PCl3(2分)
(6)Cl2+H2O=H++Cl-+HClO(2分)
【解析】
试题根据题目所给的信息,A和BDE均可以形成共价型化合物,可知A是H元素,B是N元素(AB形成化合物的水溶液显碱性),C是Na元素,D是P元素,E是Cl元素。
(1)根据原子半径变化规律,可知Na的原子半径最大;Cl的非金属性最强;
(2)H与N、P、Cl形成的氢化物NH3、PH3、HCl,PH3最不稳定(P的非金属新最弱);
(3)AE形成的化合物是HCl,A和B形成的化合物是NH3,二者反应的到的盐是NH4Cl,存在的化学键:离子键和共价键;
(4)P的最高价是+5价,最高价氧化物水化物的化学式为H3PO4。

练习册系列答案
相关题目