题目内容
【题目】铜(Cu)是一种重要的常见金属,现代电子器件的电路离不开它,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1) 向CuSO4溶液里逐滴加入氨水,首先生成蓝色难溶物,然后得到深蓝色溶液。由蓝色难溶物得到深蓝色溶液的离子方程式为__________________ ;写出该深蓝色离子能反映出特殊共价键的结构简式________________;
(2) 元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶角位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________________________;
(3) 上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的最简化学式应为________。
【答案】
(1)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- ![]()
(2)3:1 金属键
(3)Cu3AuH8
【解析】
试题分析:(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,则由蓝色难溶物得到深蓝色溶液的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;[Cu(NH3)4]2+中形成4个配位键,具有对称的空间构型,其结构简式为:![]() ;
;
(2)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Cu原子与Au原子个数之比=3:1;铜金合金属于金属晶体,金属晶体中原子间通过金属键结合;
=3,所以该合金中Cu原子与Au原子个数之比=3:1;铜金合金属于金属晶体,金属晶体中原子间通过金属键结合;
(3)氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,每个氢原子连接3个铜原子一个金原子,由于Au原子位于顶点,则8个Au原子连接8个氢原子,所以该晶胞中含有8个氢原子,则其化学式为:H8AuCu3。

【题目】(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
实验序号 | 起始读数/mL | 终点读数/mL |
I | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
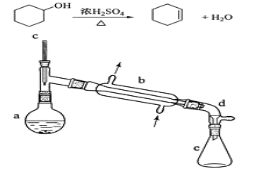
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。