题目内容
(1)25℃时,0.10mol?L-1醋酸中存在下述平衡:CH3COOH?CH3COO-+H+,若加入少量冰醋酸,平衡将向 ,溶液中c(H+)将 (填“增大”、“减小”或“不变”);
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”),H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= .
(3)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3?H2O
请根据要求填写下列空白:
溶液①呈性 (填“酸”、“碱”或“中”),其原因是 (用离子方程式表示),在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 (填序号)
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为
(3)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3?H2O
请根据要求填写下列空白:
溶液①呈性
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题
分析:(1)醋酸为弱电解质,不能完全电离,在溶液中存在电离平衡CH3COOH?CH3COO-+H+,如改变溶液中CH3COOH、CH3COO-、H+的浓度,平衡可发生移动,根据浓度对平衡移动的影响解答该题;
(2)在水溶液里只有部分电离的酸是弱酸,二元弱酸分步电离,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
(3)氯化铵是强酸弱碱盐,水解溶液呈酸性,铵根离子水解生成一水合氨和氢离子;假设铵根离子不考虑水解,依据另一种离子的影响分析判断.
(2)在水溶液里只有部分电离的酸是弱酸,二元弱酸分步电离,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
(3)氯化铵是强酸弱碱盐,水解溶液呈酸性,铵根离子水解生成一水合氨和氢离子;假设铵根离子不考虑水解,依据另一种离子的影响分析判断.
解答:
解:(1)加入少量冰醋酸,CH3COOH浓度增大,平衡向右移动,溶液中c(H+)将增大,故答案为:向电离方向移动;增大;
(2)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A?H++HA-,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)水=c(OH)=10-10 mol/L,
故答案为:弱;H2A?H++HA-;10-10 mol/L;
(3)氯化铵是强酸弱碱盐,铵根离子水解显酸性;水解离子方程式为:NH4++H2O?NH3?H2O+H+;
假设铵根离子不考虑水解,①0.1mol/L NH4Cl中铵根离子浓度0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性;④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最小的是⑤,
故答案为:酸;NH4++H2O?NH3?H2O+H+;③;⑤.
(2)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A?H++HA-,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)水=c(OH)=10-10 mol/L,
故答案为:弱;H2A?H++HA-;10-10 mol/L;
(3)氯化铵是强酸弱碱盐,铵根离子水解显酸性;水解离子方程式为:NH4++H2O?NH3?H2O+H+;
假设铵根离子不考虑水解,①0.1mol/L NH4Cl中铵根离子浓度0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性;④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最小的是⑤,
故答案为:酸;NH4++H2O?NH3?H2O+H+;③;⑤.
点评:本题考查弱电解质的电离,侧重于浓度对平衡移动的影响,溶液中离子浓度的比较,水解平衡的变化分析,溶液中的电荷守恒应用,题目难度中等.

练习册系列答案
相关题目
对甲基苯甲酸(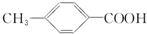 )是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为:
)是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为: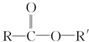 ,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
 )是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为:
)是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为: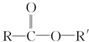 ,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列说法中,正确的是( )
| A、周期表中的主族都有非金属元素 |
| B、周期表中的主族都有金属元素 |
| C、周期表中的非金属元素都位于短周期 |
| D、周期表中的过渡元素都是金属元素 |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH为1的无色溶液:Fe2+、SO32-、Cl- |
| B、使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、碱性溶液中:Ba2+、Na+、NO3-、Cl- |
| D、加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、SO42- |
将19.0g甲烷和乙烯的混合气体通入足量的溴水后,溴水增重7.0g,则混合气体中甲烷的体积分数是( )
| A、25% | B、50% |
| C、63.2% | D、75% |
 在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差.
在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差.