题目内容
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E可能是一种金属元素 |
| B.在ECln中E与Cl之间形成共价键 |
| C.E位于元素周期表的IVA族 |
| D.E的一种氧化物为EO |
C
解析试题分析:57.4g的AgCl的物质的量是0.4mol,0.2molECln与足量的AgNO3溶液完全反应后生成0.4molAgCl,说明ECln中n=2。A、E可能为+2价金属,正确;B、ECln的熔点为-78℃,沸点为59℃比较低,根据晶体类型的熔沸点高低的判断,ECln应为分子晶体,E与Cl之间形成共价键,正确;C、元素周期表的IVA族元素的化合价一般为+4价,短周期内只有CO中C为+2价,所以E不是IVA族元素,错误;D、E的化合价为+2,所以氧化物化学式为EO,正确,答案选C。
考点:考查物质性质与结构的关系

 中考解读考点精练系列答案
中考解读考点精练系列答案在化学变化过程中,原子中的下列粒子数可能发生改变的是( )
| A.质子数 | B.中子数 | C.质量数 | D.电子数 |
下列叙述中错误的是( )
| A.原子半径:Na>Si>Cl | B.稳定性:SiH4<HCl<H2S |
| C.金属性:Na>Mg>Al | D.酸性:H3PO4<H2SO4<HClO4 |
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径A>B>D>C | B.原子序数 d > c > b > a |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
短周期元素X、Y、Z的原子序数依次增大,Y为ⅠA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是( )
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是VA族元素 | D.氢化物的稳定性:HnZ > HnX |
W、X、Y、Z、R属于短周期元素。已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2∶1。下列叙述中,错误的是
| A.分别由Y、Z组成的单质一定都为原子晶体 |
| B.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| C.Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D.X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物低 |
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
| A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z) |
| B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应 |
| C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z |
| D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液 |
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是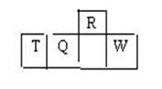
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.含T的盐溶液一定显酸性 |