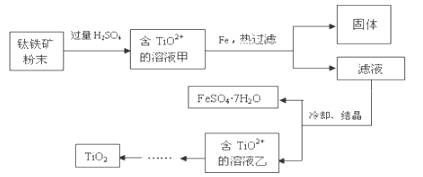
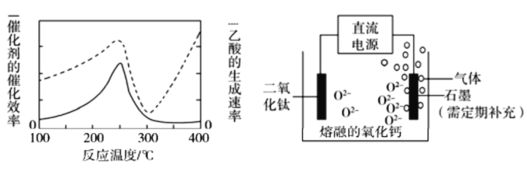
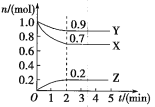
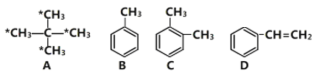
��Ŀ����
����Ŀ�����仯������ƽ��˼�����ǻ�ѧѧ�Ƶĺ�������������ʱ0.10mol/L��������Һ�д��ڶ��ƽ�⣬�����й�˵����ȷ���ǣ���֪����ʱ��Ksp��CaC2O4��=2.4��10-9���� ��
A.������Һ���ϼ�ˮϡ�ͣ���ˮ�ĵ���̶�����
B.��Һ�и�����Ũ�ȴ�С��ϵc(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-)
C.����pH�Ʋ����Һ��pH=a����H2C2O4�ĵڶ�������ƽ�ⳣ��Ka2=1013-2a
D.����Һ�м�������CaCl2��Һ���������CaCl2��ҺŨ�ȴ���2.4��10-8mol/Lʱ���ܲ�������
���𰸡�C
��������
����ˮ�ε�ˮ�ⱻ�ٽ���ˮ�ĵ���̶ȼ�С��0.10mol/L��������Һ�в��������ˮ����Һ�Լ��ԣ�������ˮ����Һ�Լ��ԣ�����ˮ��ƽ�ⳣ�������ӻ������͵���ƽ�ⳣ����������жϣ�����ksp��CaC2O4��=2.4��10-9����������c��C2O42-��=0.050mol/L������CaCl2��Һ����СŨ�ȡ�
A��������Һ�в��ϼ�ˮϡ�ͣ�����ˮ��̶�����ˮ�ĵ���̶ȼ�С����A����
B��0.10mol/L��������Һ�в�������ӷֲ�ˮ�⣬��Һ�Լ��ԣ���Һ������Ũ�ȴ�СΪ��c��Na+����c��C2O42-����c��OH-����c��HC2O4-����c��H+������B����
C������pH�Ʋ����Һ��pH=a��c��OH-��=c��HC2O4-��=10-14+amol/L��C2O42-+H2OHC2O4-+OH-��Kh=![]() =
=![]() ��
��![]() =
=![]() =
=![]() ��Ka2=1013-2a����C��ȷ��
��Ka2=1013-2a����C��ȷ��
D��ksp��CaC2O4��=c��Ca2+����c��C2O42-��=2.4��10-9��c��Ca2+��=![]() mol/L=4.8��10-8mol/L��������CaCl2��ҺŨ�ȴ���9.6��10-8mol/Lʱ���ܲ�����������D����
mol/L=4.8��10-8mol/L��������CaCl2��ҺŨ�ȴ���9.6��10-8mol/Lʱ���ܲ�����������D����
��ѡC��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�����Ŀ�������й���������ȷ����
![]() ��
��![]() ��101KPa�����£�Һ̬ˮ������Ϊ40.69kJ/mol����
��101KPa�����£�Һ̬ˮ������Ϊ40.69kJ/mol����![]()
![]()
![]() ��֪
��֪![]() ʱ��
ʱ��![]() ��
��![]() �����ڸ��¶��£����й���
�����ڸ��¶��£����й���![]() ����Һ�У�����
����Һ�У�����![]() ��
��![]() �Ƿ���ȣ�����
�Ƿ���ȣ�����![]()
![]() ��֪��
��֪��
���ۼ� | C--C |
| C--H | HһH |
���� | 348 | 610 | 413 | 436 |
��Ӧ![]()
![]()
![]()
![]()
![]() �����£���
�����£���![]() ��
��![]() ��Һ�м�������
��Һ�м�������![]() ���壬��
���壬��![]() ���뱻���ƣ���ҺpH����
���뱻���ƣ���ҺpH����
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()