题目内容
【题目】铝是一种应用广泛的金属,在工业上用![]() 和冰晶石
和冰晶石![]() 混合熔电解制得。
混合熔电解制得。
Ⅰ.铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:

(1)写出反应1中涉及的任意一个化学方程式______;
(2)滤液Ⅰ中加入的CaO生成的沉淀是_____,已知气体A在标准状况下的密度为1.96g/L,反应2的离子方程式为______;
Ⅱ.以萤石![]() 和纯碱为原料制备冰晶石的流程如下:
和纯碱为原料制备冰晶石的流程如下:

(3)萤石![]() 的电子式______;
的电子式______;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是______,写出由D制备冰晶石![]() 的化学方程式_______;
的化学方程式_______;
(5)工业电解制铝若以石墨为电极,阳极产生的混合气体的成分是_______。
【答案】2NaOH+SiO2=Na2SiO3+H2O或2NaOH+Al2O3=2NaAlO2+H2O CaSiO3 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- ![]() 浓硫酸 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O O2、CO2(CO)
浓硫酸 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O O2、CO2(CO)
【解析】
Ⅰ.铝土矿的主要成分是Al2O3和SiO2等,加入氢氧化钠溶液氧化铝溶解,过滤得到滤液偏铝酸钠溶液,二氧化硅溶解生成硅酸钠溶液,加入氧化钙生成氢氧化钙,和硅酸钠反应生成硅酸钙沉淀,过滤得到偏铝酸钠溶液,通入气体A得到氢氧化铝沉淀,煅烧氢氧化铝得到氧化铝;
Ⅱ.根据原子守恒,氟化钙和浓硫酸加热反应生成氟化氢气体和硫酸钙,氟化氢和碳酸钠、氢氧化铝反应生成冰晶石(六氟合铝酸钠)。电解氧化铝阳极生成氧气,据此解答。
I.(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O或2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;由工艺流程可知,B为氢氧化铝,A与偏铝酸钠溶液反应生成Al(OH)3沉淀,气体A在标准状况下的密度为1.96g/L,气体A的摩尔质量为1.96g/L×22.4L/mol=44g/mol,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:CaSiO3;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
II.(3)CaF2为离子化合物,电子式为![]() ,
,
故答案为:![]() ;
;
(4)由工艺流程可知,E为硫酸钙,D为最稳定的气态氢化物,D是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,
故答案为:浓硫酸;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(5)工业电解制铝若以石墨为电极,阳极反应式为2O2--4e-=O2↑,高温下C与O2反应生成CO2或CO,则阳极产生的混合气体的成分是 O2、CO2(CO)。
故答案为: O2、CO2(CO)。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】下列指定反应的化学用语表达正确的是( )
A | 质子交换膜氢氧燃料电池的负极反应 | O2+2H2O+4e﹣=4OH﹣ |
B | 用铁电极电解饱和食盐水 | 2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣ |
C | 锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡 | CO32﹣+CaSO4=CaCO3+SO42﹣ |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
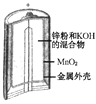
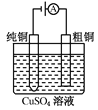
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,正极质量不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D. 图Ⅳ所示电池中,放电时,负极附近溶液的pH不变