题目内容
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
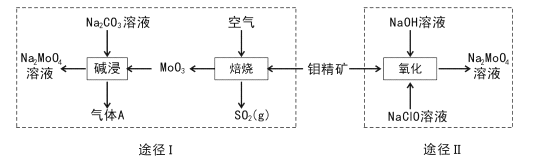
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
【答案】+6 ![]() 充分粉碎钼精矿,加压增大氧气浓度,升高温度等 2MoS2+7O2
充分粉碎钼精矿,加压增大氧气浓度,升高温度等 2MoS2+7O2![]() 2MoO3+4SO2 CO2 95% 1:9 除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体
2MoO3+4SO2 CO2 95% 1:9 除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体
【解析】
(l) Na2 MoO4.2H2O中根据各元素化合价的代数和为零,计算钼元素的化合价为+6价;NaClO为离子化合物,其的电子式为![]() ;
;
(2) 途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度;
(3)途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
(4)根据Ksp(BaMo04) =4.0×10-8, BaMoO4开始沉淀时,则c(Ba2+)= Ksp(BaMo04)/c(Mo042-)=4.0×10-8/0. 40=1.0×10-7 mol/L,此时溶液中c(CO32-)= Ksp(BaCO3)/ c(Ba2+)=1×10-9/1.0×10-7=0.01mol/L,CO32-的去除率=(0. 20mol/L-0.01mol/L)/0. 20mol/L=95%;
(5)途径II氧化时还原剂为MoS2、氧化剂为NaClO, 生成物为Na2SO4和Na2 MoO4,反应中Mo化合价由+4价变为+6价,S由-2变为+6,1mol MoS2失去16mol电子,NaClO中Cl的化合价由+1变为-1,1mol得到2mol电子,则还原剂与氧化剂物质的量之比1:9;
(6) 重结晶为根据可溶物的溶解度不同,利用多次结晶得到较纯的物质,其操作的目的为除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体;
(l) Na2 MoO4.2H2O中根据各元素化合价的代数和为零,计算钼元素的化合价为+6价;NaClO为离子化合物,其的电子式为![]() ;
;
(2) 途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度,答案为:充分粉碎钼精矿,加压增大氧气浓度,升高温度等;
(3)途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
2MoO3+4SO2;根据元素守恒,产物Na2MoO4中无碳元素,则气体中含碳元素,气体A为二氧化碳,则碱浸时气体A的化学式为CO2;
(4)根据Ksp(BaMo04) =4.0×10-8, BaMoO4开始沉淀时,则c(Ba2+)= Ksp(BaMo04)/c(Mo042-)=4.0×10-8/0. 40=1.0×10-7 mol/L,此时溶液中c(CO32-)= Ksp(BaCO3)/ c(Ba2+)=1×10-9/1.0×10-7=0.01mol/L,CO32-的去除率=(0. 20mol/L-0.01mol/L)/0. 20mol/L=95%;
(5)途径II氧化时还原剂为MoS2、氧化剂为NaClO, 生成物为Na2SO4和Na2 MoO4,反应中Mo化合价由+4价变为+6价,S由-2变为+6,1mol MoS2失去16mol电子,NaClO中Cl的化合价由+1变为-1,1mol得到2mol电子,则还原剂与氧化剂物质的量之比1:9;
(6) 重结晶为根据可溶物的溶解度不同,利用多次结晶得到较纯的物质,其操作的目的为除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体;

【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
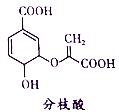
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
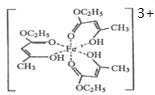
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
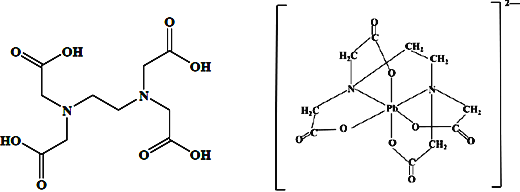
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。