题目内容
【题目】元素周期表中常见非金属元素形成的化合物与新能源和新环境问题密切相关。
(1)我国于2016年10月17日由长征号FY11运载火箭发射神舟十号飞船,其推力能量主要是压缩成液体燃料(CH3)2N-NH2和氧化剂N2O4,该燃料组燃烧后产生巨大能量,释放产物为无毒无害的气体。298K时,10g燃料完全燃烧释放的能量为425kJ,请写出该反应的热化学方程式
_____________。
(2)二氧化硫、氮氧化物以及可吸入颗粒物(PM2.5 等)这三项是雾霾主要组成。其中炭还原法处理氮氧化物是一种方法。T℃时反应C(s)+2NO(g)![]() N2(g) + CO2(g),反应始终从反应物投料开始,测定各时间点的物质浓度图像如下:
N2(g) + CO2(g),反应始终从反应物投料开始,测定各时间点的物质浓度图像如下:

① 第一次平衡前,CO2的平均反应速率v (CO2)=____________;
② 若反应在T℃进行,只改变起始反应物投料,某时刻测得C(NO)=4 mol/L, C(N2) =4mol/L,则此时V(正)_____V(逆)(填“>”、“<”或“=”) ;
③ 根据图像判断,40min时改变的条件可能是__________;
A.恒压条件下通入NO; B.升高温度; C.(恒容条件)通入NO; D.压缩体积;
E.恒压时加入活性炭; F.使用新型催化剂。
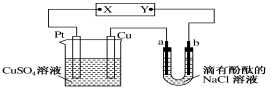
(3)新能源应用探索中,可以用下图装置于净化处理厕所排放废水中的尿素(H2NCONH2),同时产生电能。请写出负极电极反应式:_____________;

(4)工业上使用氨碱吸收SO2,然后使之转化成NH4HSO4,可作分析试剂使用,现用0.1mol/LKOH来滴定100mL0.1mol/L NH4HSO4,反应过程的滴定曲线如下图:
已知:常温时NH3·H2O的电离常数K=1.8×10-5,忽略溶液混合后体积变化,请根据图中给出的5个点的字母回答相关问题。

①滴定过程中以上5个点中,_________点水电离程度最小;
②滴定过程中Z点溶液中各离子浓度由大到小的排列顺序是_________;
③滴定过程中M点的pH大约是(填整数)___________。
【答案】 C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2 (g)+4H2O(l) ΔH=-2550 kJ/mol 0.05mol·L-1·min-1 > D H2NCONH2+H2O﹣6e﹣═CO2+N2+6H+ X C(K+)>C(SO42- )>C(NH4+)>C(H+)=C(OH-) 9
【解析】(1)10g燃料是10g÷60g/mol=1/6mol,完全燃烧释放的能量为425kJ,则1mol完全燃烧放热是425kJ×6=2550kJ,因此该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2 (g)+4H2O(l) ΔH=-2550 kJ/mol。(2)①根据图像可知第一次平衡时消耗NO是3mol/L,根据方程式可知生成CO2是1.5mol/L,所以第一次平衡前,CO2的平均反应速率v (CO2)=1.5mol/L÷30min=0.05mol·L-1·min-1;②平衡时NO、氮气和二氧化碳的浓度分别是1mol/L、1.5mol/L、1.5mol/L,所以平衡常数K=![]() ;若反应在T℃进行,只改变起始反应物投料,某时刻测得c(NO)=4mol/L,c(N2)=4mol/L,根据方程式可知二氧化碳是4mol/L,则浓度熵=
;若反应在T℃进行,只改变起始反应物投料,某时刻测得c(NO)=4mol/L,c(N2)=4mol/L,根据方程式可知二氧化碳是4mol/L,则浓度熵=![]() <2.25,所以此时V(正)>V(逆);③根据图像判断,40min时NO浓度瞬间变大,但平衡不移动,由于反应前后体积不变,所以改变的条件可能是压缩体积,答案选D。(3)负极是尿素失去电子,则电极反应式为H2NCONH2+H2O﹣6e﹣=CO2+N2+6H+;(4)①X、Y、Z、M、N五个点中X点是100mL0.1mol/L NH4HSO4溶液的pH,铵根离子水解显酸性,电离出的氢离子对水解起到抑制作用,N点是恰好反应时,所以X点水电离程度最小;②Z点溶液呈中性,即溶液含有(NH4)2SO4、K2SO4、NH3H2O三种成分,Y点时c(K+)=c(SO42-),Z点时c(K+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(K+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-);③滴定过程中M点加入氢氧化钾是150mL,溶液中一水合氨和铵根的浓度相等,所以根据常温时NH3·H2O的电离常数K=1.8×10-5,溶液中氢氧根浓度是1.8×10-5mol/L,所以氢离子浓度约是10-9mol/L,则pH=9。
<2.25,所以此时V(正)>V(逆);③根据图像判断,40min时NO浓度瞬间变大,但平衡不移动,由于反应前后体积不变,所以改变的条件可能是压缩体积,答案选D。(3)负极是尿素失去电子,则电极反应式为H2NCONH2+H2O﹣6e﹣=CO2+N2+6H+;(4)①X、Y、Z、M、N五个点中X点是100mL0.1mol/L NH4HSO4溶液的pH,铵根离子水解显酸性,电离出的氢离子对水解起到抑制作用,N点是恰好反应时,所以X点水电离程度最小;②Z点溶液呈中性,即溶液含有(NH4)2SO4、K2SO4、NH3H2O三种成分,Y点时c(K+)=c(SO42-),Z点时c(K+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(K+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-);③滴定过程中M点加入氢氧化钾是150mL,溶液中一水合氨和铵根的浓度相等,所以根据常温时NH3·H2O的电离常数K=1.8×10-5,溶液中氢氧根浓度是1.8×10-5mol/L,所以氢离子浓度约是10-9mol/L,则pH=9。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】在四支试管中发生反应:Mg+2HCl=MgCl2+H2↑,生成H2的速率最大的是( )
试管 | 等质量镁的形状 | 盐酸的浓度 (mol·L-1) | 温度(℃) |
A | 条状 | 0.1 | 30 |
B | 条状 | 0.1 | 40 |
C | 粉末状 | 0.1 | 40 |
D | 粉末状 | 0.5 | 40 |
A. AB. BC. CD. D