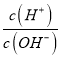题目内容
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质),某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有氧化性。
(1)滤液A的主要成分_____(填写化学式),滤液B所含金属阳离子为________。
(2)反应①的离子方程式是_________。
(3)反应①之前要洗涤滤渣B,对滤渣B进行“洗涤”的实验操作方法是________。
(4)反应②的化学反应方程式是____________。
(5)稀土元素的提纯,还可采用萃取法。己知化合物HT作为萃取剂能将铈离子从水溶液萃取出来,过程表示为Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3(有机层)+3H2SO4(水层),用________ (填主要仪器)分液的到CeT3(有机层),再加入H2SO4获得较纯净的含Ce3+的水溶液。可选择硫酸作反萃取的原因是________。
2CeT3(有机层)+3H2SO4(水层),用________ (填主要仪器)分液的到CeT3(有机层),再加入H2SO4获得较纯净的含Ce3+的水溶液。可选择硫酸作反萃取的原因是________。
(6)用滴定法测定制得的Ce2(SO4)3产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得Ce(OH)4产品的质量分数______。(填“偏大”、“偏小”或“无影响”)
【答案】 Na2SiO3 Fe2+、Fe3+ 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次 4Ce(OH)3+ O2+4H2O=4Ce(OH)4 分液漏斗 加入硫酸,可使平衡向左进行,使Ce3+进入水层 偏大
【解析】(1)根据以上分析可知滤液A的主要成分 Na2SiO3,滤液B所含金属阳离子为Fe2+、Fe3+。(2)由于酸性条件下,Ce4+有氧化性,所以反应①的离子方程式是2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O。(3)反应①之前要洗涤滤渣B,洗涤沉淀需要在过滤器中完成,则实验操作是沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次。(4)反应②的化学反应方程式是4Ce(OH)3+ O2+4H2O=4Ce(OH)4。(5)萃取后的操作是分液,需要分液漏斗;根据方程式Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3(有机层)+3H2SO4(水层)可知加入硫酸,可使平衡向左进行,使Ce3+进入水层,因此可选择硫酸作反萃取。(6)若所用FeSO4溶液在空气中露置一段时间后再进行滴定,由于硫酸亚铁被氧化为硫酸铁,导致消耗标准液体积增加,所以测得Ce(OH)4产品的质量分数偏大。
2CeT3(有机层)+3H2SO4(水层)可知加入硫酸,可使平衡向左进行,使Ce3+进入水层,因此可选择硫酸作反萃取。(6)若所用FeSO4溶液在空气中露置一段时间后再进行滴定,由于硫酸亚铁被氧化为硫酸铁,导致消耗标准液体积增加,所以测得Ce(OH)4产品的质量分数偏大。