题目内容
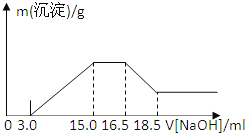
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示:
下列结论正确的是( )
A.铝与混合溶液反应的离子方程式为8Al+30H++3NO3=8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4:3
D.混合液中硫酸的物质的量的浓度为0.72 mol/L
【答案】A
【解析】
A. 硝酸根浓度很低时被氧化生成的产物是铵根离子,因此无气体放出,镁、铝反应生成金属阳离子,则离子反应分别为4Mg+10H++NO3=4Mg2++NH4++3H2O、8Al+30H++3NO3=8Al3++3NH4++9H2O,A项正确;
B. 由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,则原溶液中NO3物质的量是(16.5-15)×103L×4mol/L=0.006mol,B项错误;
C. 从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,由Al~Al3+~Al(OH)3~NaOH,则Al的物质的量为0.008mol,再由Mg2++2OH=Mg(OH)2↓、Al3++3OH=Al(OH)3↓,沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×103L×4.00mol/L-8×103mol×3=24×103mol,镁离子物质的量为1.2×102mol,参加反应的镁与铝的质量之比:8×103mol×27g/mol:1.2×102mol×24g/mol=3:4,C项错误;
D. 由4Mg+10H++NO3=4Mg2++NH4++3H2O、8Al+30H++3NO3=8Al3++3NH4++9H2O可知,消耗氢离子为0.008mol×![]() +1.2×102mol×
+1.2×102mol×![]() =0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×103L×4mol/L=0.012mol,原溶液中硫酸的物质的量为
=0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×103L×4mol/L=0.012mol,原溶液中硫酸的物质的量为![]() =0.036mol,混合液中硫酸的物质的量的浓度为
=0.036mol,混合液中硫酸的物质的量的浓度为![]() =0.36mol/L,D项错误;
=0.36mol/L,D项错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案