题目内容
向一定量的Fe、Fe0、Fe304的混合物中加人100mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,生成224 mL(标准状况)气体,向溶液中滴加KSCN溶液无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为
| A.2.8 g | B.5.6 g | C.11.2 g | D.无法计算 |
A
解析试题分析:由题意知溶液是氯化亚铁溶液,其物质的量是氯离子的一半,所以n(Fe2+)=0.05mol,根据元素守恒,用足量的CO在高温下还原相同质量的此混合物,能得到铁的物质的量仍为0.05mol,所以质量是2.8g,答案选A。
考点:考查元素守恒法在化学计算中的应用

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
| C.78 g苯中含有碳碳双键的数目为3NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
①常温常压下,18g14CH4所含中子数目为8 NA
②1L0.1mol·L-1的氨水中有NA个NH4+
③1mol Na2O2中含有NA个阴离子
④1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA
⑤78g 苯含有C=C双键的数目为3NA
⑥0.1molN2和0.3molH2在某密闭容器中充分反应,转移电子的数目为0.6NA
⑦60gSiO2晶体中含有硅氧键的数目为4NA
| A.①③⑦ | B.②③⑥ | C.②④⑥ | D.①④⑤⑦ |
用NA表示阿伏加德罗常数,下列结论能够成立的是
| A.0.1 mol·L-1的Na2CO3溶液中含有CO32-的个数是小于0.1NA |
| B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA |
| C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加1倍,其浓度变为0.1 mol·L-1 |
| D.4g NaOH固体溶解1L水中,所得溶液的物质的量浓度为0.1mol/L |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )。
| A.等物质的量的CO2和NH3中所含的分子数均为NA |
| B.标准状况下,33.6 L SO3中含有的氧原子数是4.5NA |
| C.常温下,34.5 g NO2与N2O4的混合物中含有1.5NA个氧原子 |
| D.电解精炼铜时,每转移2NA个电子,阳极溶解64 g铜 |
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是( )。
| A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA |
| B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA |
| C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g |
| D.3.4 g NH3中含N—H键数目为0.6 NA |
下列叙述正确的是 ( )。
| A.1 L 0.1 mol·L-1碳酸钠溶液的阴离子总数等于0.1NA |
| B.将1体积c mol·L-1硫酸用水稀释为5体积,得到0.2c mol·L-1硫酸 |
| C.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol·L-1 |
D.将w g a%NaCl溶液蒸发掉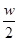 g水,得到4a% NaCl溶液 g水,得到4a% NaCl溶液 |
把a L含(NH4)2SO4和NH4NO3的混合液分成2等份,一份用b mol的NaOH刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol的BaCl2,则原溶液中c(NO3-)为( )
| A.(b-2c)/a mol·L-1 | B.(2b-4c)/a mol·L-1 |
| C.(2b-c)/a mol·L-1 | D.(b-2c)/2a mol·L-1 |