题目内容
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
| C.78 g苯中含有碳碳双键的数目为3NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
D
解析试题分析:n(NaClO)=1mol.但是由于NaClO 是强碱弱酸盐,ClO-会发生水解反应而消耗,所以溶液中含有ClO-的数目小于NA。错误。B.pH=1的醋酸溶液中,c(H+)=0.1mol/L;由于没有给出溶液的体积,所以无法计算微粒的物质的量及个数的多少。错误。C苯分子中碳原子与碳原子之间的化学键是一种特殊的化学键,是一种介于C—C单键和C=C双键之间的一种独特的化学键。所以不能说含有碳碳双键的数目的多少。错误。D。n(NO2)=6.72L÷22.4L/mol=0.3mol.遇水会发生反应:3NO2+ H2O == 2HNO3+ NO。每有3mol的NO2发生反应,转移电子2mol.现在NO2的物质的量为0.3mol,所以与水充分反应转移的电子的物质的量为0.2mol,数目为0.2NA正确。
考点:考查阿伏加德罗常数在物质的组成、结构、性质等计算中的应用的知识。

 阅读快车系列答案
阅读快车系列答案用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
| A.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| B.0.5molC3H8分子中所含C-H共价键数为2NA |
| C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA |
D.1mol碳正离子 所含的电子数为11NA 所含的电子数为11NA |
把a L硫酸铵和硝酸铵混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。原溶液中NO3-的物质的量浓度是( )
A.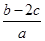 mol·L-1 mol·L-1 | B.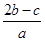 mol·L-1 mol·L-1 |
C.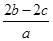 mol·L-1 mol·L-1 | D.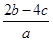 mol·L-1 mol·L-1 |
向一定量的Fe、Fe0、Fe304的混合物中加人100mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,生成224 mL(标准状况)气体,向溶液中滴加KSCN溶液无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为
| A.2.8 g | B.5.6 g | C.11.2 g | D.无法计算 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.0.lmol·L-1Na2CO3溶液中含有0.1NA个CO32- |
| B.l7gNH3中含有3NA个氢原子 |
| C.常温常压下,11.2L甲烷含有共价键数为2NA |
| D.标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.1 mol Al3+离子含有的核外电子数为3NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是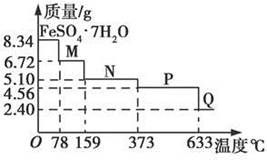
| A.温度为78℃时固体物质M的化学式为FeSO4·5H2O |
| B.温度为159℃时固体物质N的化学式为FeSO4·3H2O |
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |
在100 g浓度为18 mol·L-1,密度为ρ(g·cm-3)的浓硫酸中加入一定量的水稀释成9 mol·L-1的硫酸,则加入水的体积为
| A.小于100 mL | B.等于100 mL |
| C.大于100 mL | D.小于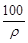 mL mL |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 |
| B.O2比O3的质量小 |
| C.两种气体的分子数目相等 |
| D.两种气体的氧原子数目相等 |