题目内容
化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1) 在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式:
。
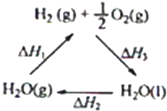
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(Ⅱ)下图为相互串联的甲乙两个电解池:

请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是 ,电极反应为 ,
B极是 极,材料是 ,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
________________________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
(Ⅰ)(1)CH4(g)+2O2(g)==== CO2(g)+ 2H2O(g) ΔH = —880 kJ/mol
(2)+260 kJ/mol
(3)NO2(g)+CO(g)==== CO2(g)+NO(g) ΔH = —234 kJ/mol
(Ⅱ)(1)阴 纯铜 Cu2++2e-=Cu 阳 粗铜 Cu-2e-=Cu2+ CuSO4溶液
(2)红 (3)2.24 L (4)0.5 mol/L
【解析】

 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ① |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 |
| B、该过程实现了太阳能向化学能的转化 |
| C、图中△H1=△H2+△H3 |
| D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |


