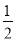题目内容
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为(提示:①H2C2O4是二元弱酸;②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O)
A.0.008889 B.0.0800 C.0.1200 D.0.2400
B
【解析】根据题目方程式得出关系式:10[KHC2O4·H2C2O4]~8KMnO4,还有关系式:KHC2O4·H2C2O4~3NaOH,设KMnO4溶液的物质的量浓度为x,则列式: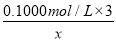 =
=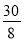 ,解得x=0.0800 mol·L-1。
,解得x=0.0800 mol·L-1。

练习册系列答案
相关题目