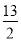题目内容
313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
A.呈酸性 B.呈中性 C.呈碱性 D.无法判断
C
【解析】解答本题时应注意以下两点:
(1)判断溶液的酸碱性最根本的依据是溶液中c(H+)与c(OH-)的相对大小;
(2)根据水在一定温度下的KW可以通过计算确定溶液呈中性时的c(H+)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下面是有关弱酸的电离平衡常数。
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 (25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
结合数据,分析下列有关说法,其中错误的是( )
A.1 mol·L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大
C.向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动
D.向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动