题目内容
【题目】硫、碳、氮等是重要的非金属元素。请回答下列有关问题:
(1)H2S广泛存在于化石燃料中,因此H2S的吸收和利用是化石燃料化工中的一项重要任务。
①H2S可用NaClO溶液吸收,吸收后的溶液既能使AgNO3溶液生成白色沉淀,也能使Ba(NO3)2 溶液生成白色沉淀,则H2S用过量NaClO溶液吸收的离子方程式为_______________________。
②利用多硫化物(如Na2Sx)吸收H2S,其吸收原理可用以下四步反应表示:
ⅰ.H2S+OH-=HS-+H2O; ⅱ.2HS-![]() H2↑+S22-;
H2↑+S22-;
ⅲ.H2S+S22-=2HS-+S↓; ⅳ.HS-+H2O=H2S+OH-。
四步反应的总反应中的生成物是_______,在总反应中,多硫化物的作用是_____________。
(2)25℃时,H2CO3、NH3H2O在水中的电离平衡常数如下表:
弱电解质 | H2CO3 | NH3H2O |
电离常数 | Ka1=4.0×l0-7 Ka2=5.0×l0-11 | Kb=2.0×10-5 |
①判断0.1 molL-1的(NH4)2CO3溶液呈_______性(填“酸”“中”或“碱”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度由大到小的顺序为______________。
②0.50 mol L-1的Na2CO3溶液的pH=_______(忽略CO32-第二步水解和H2O的电离)。
③25℃时,Mg(OH)2的Ksp=2.0×10-11,要使0.002 molL-1的MgSO4溶液中生成Mg(OH)2沉淀,应调整溶液pH不低于________。
【答案】 6ClO-+H2S=4Cl-+SO42-+2HClO H2、S 催化剂和溶剂 碱 c(NH4+)>c(CO32-)>c(HCO3-) 12 10
【解析】本题考查化学工艺流程,(1)①反应后的溶液能使AgNO3溶液产生白色沉淀,说明含有Cl-,即ClO-→Cl-,也能使Ba(NO3)2溶液生成白色沉淀,说明有SO42-的生成,即H2S→SO42-,离子反应方程式为ClO-+H2S→Cl-+SO42-,根据化合价升降法进行配平,4ClO-+H2S→4Cl-+SO42-,反应前后所带电荷数守恒,因此反应后有4molH+,因为NaClO是过量,发生H+与ClO-反应生成HClO,即离子反应方程式为:6ClO-+H2S=4Cl-+SO42-+2HClO;②四个反应方程方式相加,得到H2S=H2+S,因此生成物是H2和S,多硫化物的作用是催化剂和溶剂;(2)根据水解平衡常数、电离平衡常数、水的离子积之间的关系, ![]() ,NH4+的水解常数为1×10-14/2.0×10-5=5×10-10,CO32-的水解常数为1×10-14/5×10-11=2×10-4,NH4+的水解程度小于CO32-的水解程度,溶液显碱性,离子浓度大小顺序是c(NH4+)>c(CO32-)>c(HCO3-);②CO32-的水解常数为1×10-14/5×10-11=2×10-4,Kh=
,NH4+的水解常数为1×10-14/2.0×10-5=5×10-10,CO32-的水解常数为1×10-14/5×10-11=2×10-4,NH4+的水解程度小于CO32-的水解程度,溶液显碱性,离子浓度大小顺序是c(NH4+)>c(CO32-)>c(HCO3-);②CO32-的水解常数为1×10-14/5×10-11=2×10-4,Kh=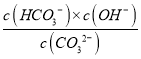 ,水解的程度微弱,c(CO32-)=0.5mol·L-1,CO32-+H2O
,水解的程度微弱,c(CO32-)=0.5mol·L-1,CO32-+H2O![]() HCO3-+OH-,c(HCO3-)=c(OH-),c(OH-)=
HCO3-+OH-,c(HCO3-)=c(OH-),c(OH-)= ![]() mol·L-1=1×10-2mol·L-1,即pH=12;③要使出现氢氧化镁沉淀,满足Ksp=c(Mg2+)×c2(OH-),c(OH-)=
mol·L-1=1×10-2mol·L-1,即pH=12;③要使出现氢氧化镁沉淀,满足Ksp=c(Mg2+)×c2(OH-),c(OH-)= 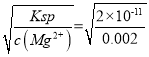 =10-4mol·L-1,即pH=10。
=10-4mol·L-1,即pH=10。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

