题目内容
(9分)取50mL含Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成2.016 LCO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33g。试计算原混合溶液中Na2CO3和Na2SO4 的物质的量浓度分别是多少。(请写出计算过程)
(9分) Na2CO3 的物质的量浓度1.8 mol/L
Na2SO4 的物质的量浓度0.2 mol/L
Na2SO4 的物质的量浓度0.2 mol/L
考查物质的量的有关计算。
(1)生成的CO2体积是2.016L
所以在标准状况下的体积是2.016L÷22.4L/mol=0.09mol
根据反应的化学方程式可知
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1mol 1mol
0.09mol 0.09mol
所以根据c=n/V可知
碳酸钠溶液的浓度是0.09mol÷0.05L=1.8mol/L
(2)生成的白色沉淀是硫酸钡
物质的量是2.33g÷233g/mol=0.01mol
所以根据反应的化学方程式可知
Na2SO4+Ba(OH)2=2NaOH+BaSO4↓
1mol 1mol
0.01mol 0.01mol
根据c=n/V可知
所以硫酸钠溶液的浓度是0.01mol÷0.05mol=0.2mol/L
(1)生成的CO2体积是2.016L
所以在标准状况下的体积是2.016L÷22.4L/mol=0.09mol
根据反应的化学方程式可知
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1mol 1mol
0.09mol 0.09mol
所以根据c=n/V可知
碳酸钠溶液的浓度是0.09mol÷0.05L=1.8mol/L
(2)生成的白色沉淀是硫酸钡
物质的量是2.33g÷233g/mol=0.01mol
所以根据反应的化学方程式可知
Na2SO4+Ba(OH)2=2NaOH+BaSO4↓
1mol 1mol
0.01mol 0.01mol
根据c=n/V可知
所以硫酸钠溶液的浓度是0.01mol÷0.05mol=0.2mol/L

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
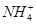 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( ) ×100%
×100% mol·L-1
mol·L-1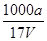 mol·L-1
mol·L-1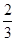 NA
NA