题目内容
1.有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:(1)AH、BO、CAl、DS、EK(填元素符号);
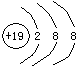
(2)E正一价离子的结构示意图
 ;
;(3)写出C元素基态原子的电子排布式1s22s22p63s23p1,该元素形成的晶体属于金属晶体,其熔沸点比Na高(填“低”或“高”),这是因为Al半径小于Na,价电子数比Na多,所以金属键强,熔沸点高;
(4)由这五种元素组成的一种化合物是(写名称)明矾,写出该物质的一种主要用途净水剂.
分析 B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,则B和D属于第ⅥA族元素,A和E属同一族,它们原子的最外层电子排布为ns1,则A和E为ⅠA族元素,C原子最外层上电子数等于D原子最外层上电子数的一半,则C为ⅢA族元素,A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素,则C为Al,E为K,进一步确定A为H,B为O,D为S,据此答题.
解答 解:B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,则B和D属于第ⅥA族元素,A和E属同一族,它们原子的最外层电子排布为ns1,则A和E为ⅠA族元素,C原子最外层上电子数等于D原子最外层上电子数的一半,则C为ⅢA族元素,A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素,则C为Al,E为K,进一步确定A为H,B为O,D为S,
(1)由上面的分析可知,A为H,B为O,C为Al,D为S,E为K,
故答案为:H、O、Al、S、K;
(2)钾离子的结构示意图为 ,故答案为:
,故答案为: ;
;
(3)C为Al,是13号元素,其基态原子的电子排布式为 1s22s22p63s23p1,铝元素形成的晶体属于金属晶体,由于Al半径小于Na,价电子数比Na多,所以金属键强,熔沸点高,
故答案为:1s22s22p63s23p1;金属;高;Al半径小于Na,价电子数比Na多,所以金属键强,熔沸点高;
(4)由H、O、Al、S、K五种元素组成的一种化合物是明矾,明矾可作净水剂,故答案为:明矾;净水剂.
点评 本题考查结构性质位置关系,元素的推断是解答的关键,题目难度不大,注意信息的综合应用来推断,较好的训练学生分析解决问题的能力,旨在考查学生对基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列反应是氧化还原反应的是( )
| A. | Ca(OH)2+CO2═CaCO3+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2+2H2O═4NaOH+O2 | D. | 2NaHCO3═Na2CO3+CO2+H2O |
6.设NA为阿伏伽德常数的数值,下列说法正确的是( )
| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol甲苯含有6NA个C-H键 | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
13.下列溶液中微粒浓度关系一定正确的是( )
| A. | 0.1Lmol.L-1的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) | |
| B. | 醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| C. | 将pH=5的H2SO4溶液稀释1×103倍后,c(H+):c(SO42-)=2:1 | |
| D. | 常温下,pH=4的NaHC2O4溶液中:c(C2O42-)<c(H2C2O4) |
6.下列溶液中,必须通过焰色反应才能鉴别的一组是( )
| A. | Na2CO3 KCl | B. | NaCl KCl | C. | CaCl2 NaCl | D. | K2CO3 CaCl2 |

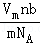 B.
B.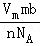 C.
C. D.
D.