题目内容
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
| A.+4 | B.+5 | C.+6 | D.+7 |
B
解析试题分析:RO3n-中,元素R的化合价是+(6-n),反应后R的化合价是+7价,失去7-(6-n)=(1+n)个电子。F元素的化合价从0价降低到-1价,得到1个电子,则根据电子得失守恒并依据反应的方程式可知1+n=2,解得n=1,所以在RO3n-中,元素R的化合价是+(6-n)=+5价,答案选B。
考点:考查氧化还原反应中元素化合价的计算

NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
| A.224mL | B.336mL | C.448mL | D.672mL |
a mol FeS与b mol FeO投入到VL、c mol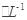 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)x63g ②(a+b)x189g ③(a+b)mol ④(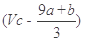 )mol
)mol
| A.①④ | B.②③ | C.①③ | D.②④ |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e-→ SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯 气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
臭氧可使湿润的淀粉KI试纸变蓝,化学方程式为2KI+O3+H2O=2KOH+I2+O2。下列叙述中正确的是( )
| A.在反应中水被氧化成氧气 | B.该反应中水是氧化剂 |
| C.每生成1 mol I2,转移的电子数为1 mol | D.反应中氧化剂与还原剂的物质的量之比为1∶2 |
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
| A.Cl2>I2>Fe3+>SO24- | B.Cl2>Fe3+>I2>SO24- |
| C.Fe3+>Cl2>I2>SO24- | D.Cl2>Fe3+>SO24->I2 |
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可在一定条件下合成:Al2O3 + N2 + 3C → 2AlN + 3CO。下列叙述正确的是( )
| A.上述反应中, N2是还原剂,Al2O3是氧化剂; |
| B.上述反应中,每生成 1mol AlN需转移3mol 电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2 2Na2FeO4+Na2O
2Na2FeO4+Na2O
关于该反应说法正确的是
| A.反应中Na2O2是氧化剂 |
| B.Fe2O3可以通过铁丝在氧气中燃烧制得 |
| C.生成1 mol Na2FeO4,有6 mol电子转移 |
| D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )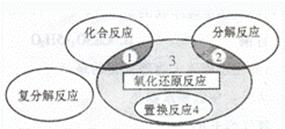
| A.4Fe(OH)2+O2+2H2O =Fe(OH)3 |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.4NH3+5O2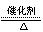 4NO+6H2O 4NO+6H2O |
| D.Zn+H2SO4=ZnSO4 + H2 ↑ |